用于体外血液毒性测试的HemaTox™培养基和补充剂
为什么使用HemaTox™试剂盒?
- 与IC中适当的CFU测定进行比较50测定,现行标准为体外IC50的决心。
- 优化的无血清培养基和补充剂提供强大的扩展,允许一致的结果。
- 试验化合物可在培养开始时添加,以在分化前检查对祖细胞的影响,或在培养过程中添加,以研究对更多分化细胞的影响。可以使用不同的读出方法,例如流式细胞术。
数据

图1所示。通用HemaTox™试剂盒操作步骤
*如果预先富集CD34,可以省略细胞分离步骤+使用细胞。

图2。流式细胞术图显示CD34培养后产生的细胞+造血干细胞与HemaTox™红系、髓系和巨核细胞试剂盒
(A)人CB CD34+用(B) HemaTox™红系、(C)髓系和(D)巨核细胞试剂盒按照上述方案培养细胞。在适当的培养期后,收集细胞并分别染色红细胞(CD71和GlyA)、髓细胞(CD13和CD15)或巨核细胞(CD45和CD41)上表达的细胞表面蛋白。
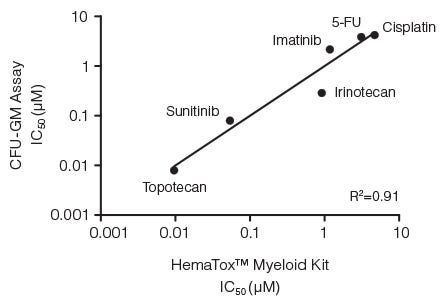
图3。IC之间的相关性50使用CFU-GM检测和96孔板液体培养为基础的HemaTox™髓系试剂盒测量六种药物的值
人BM CD34+细胞用MethoCult™培养基进行集落形成单位-粒细胞/巨噬细胞(CFU-GM)试验,用HemaTox™髓系试剂盒进行液体培养。集成电路50在X轴和Y轴上绘制了使用每种测定法生成的值,并显示出与决定系数(R)高度相关2)为0.91。

图4。用HemaTox™红系、髓系和巨核细胞试剂盒鉴定血液毒性的谱系特异性差异
结果显示,平均集成电路50在人BM CD34上测试的每种药物的值+使用HemaTox™红细胞(灰色),髓细胞(金色)和巨核细胞(橙色)试剂盒。大多数药物对每个谱系都显示出相似的毒性,但有些药物,如舒尼替尼,对红细胞的毒性比巨核细胞祖细胞分化的毒性高100倍,对髓祖细胞分化的毒性中等。竖线表示平均值的标准误差(SEM) (n = 4 - 8)。