毒性测试
提供合约化验服务
毒性是治疗药物开发中损耗的主要原因,也是选择候选药物通过开发管道推进时的关键考虑因素。扩大临床前测试以纳入在开发过程早期更好地预测潜在毒性的分析,对于选择成功的主要候选药物具有明显的优势。体外测试可以让研究人员预览体内反应,从而促进临床前试验和I期临床试验中设计更好的给药策略和优化动物模型。
干细胞的合约化验服务(CAS)专门进行体外分析测量候选疗法的潜在毒性作用,包括小分子化合物和生物制剂。它产生骨、脂肪和软骨的关键成分,也可以在集落形成单位-成纤维细胞(CFU-F)试验中进行测试,以预测可能的细胞毒性作用。小鼠肠道类器官也可用于评估候选疗法对细胞活力的影响。
联系我们有关如何修改以下各节中的每个分析以满足您的特定目标的更深入讨论。
菌落形成单位(CFU)测定
我们可以使用标准化和定制设计的方法评估候选疗法对红细胞、髓细胞和巨核细胞祖细胞的血液毒性菌落形成单位(CFU)测定(也称为集落形成细胞(CFC)试验)。
CFU检测的优点
- 产生临床预测信息1,2从而实现更好的计划和更少的体内研究
- 使用来自人类,非人类灵长类动物,小鼠,大鼠或狗的原代造血细胞,以协助选择合适的动物模型
- 评估红系(BFU-E)和髓系(CFU-GM)祖细胞的增殖和分化


- Pessina A等人(2003)应用CFU-GM检测预测急性药物性中性粒细胞减少症:一项验证骨髓抑制异种抗生素最大耐受剂量(MTD)预测模型的国际盲试验。毒物科学75(2):355-367。
- Pessina A et al.(2009)应用人CFU-Mk测定预测药物潜在的血小板毒性。体外毒物学23(1):194-200。
基于液体培养的血液毒性试验
以HemaTox™液体培养基为基础的检测方法的优势
- 评估红细胞、髓细胞和巨核细胞祖细胞在< 10天内的增殖和分化
- 允许96孔格式的高通量化合物测试
- 与CFU测定多种化合物的毒性水平相关
- 允许高度的灵活性,因为测试化合物可以在不同的时间点添加到培养物中,允许在不同的分化阶段检查对祖细胞的影响
- 提高了抗增殖效果评估的敏感性

图2。HemaTox™分析工作流程

图3。IC之间的相关性50和集成电路90使用CFU-GM检测和液体基HemaTox™髓系检测43种测试化合物的值

图4。不同5-FU治疗方案的剂量-反应曲线
CD34+细胞在整个培养过程中连续暴露于5-氟尿嘧啶(红色,连续),第0天短暂暴露24小时,然后冲洗药物(黑色,24小时处理,第0天),第6天短暂暴露24小时(蓝色,24小时处理,第6天),此时已经存在骨髓祖细胞。数据显示为平均生长,作为对照的百分比,从单一代表性供体的三个培养井中获得。误差条表示标准差。
AZT案例研究
叠氮胸苷(Azidothymidine, AZT)是一种抗病毒核苷类似物,可靶向病毒聚合酶,但也可抑制细胞聚合酶,导致细胞增殖下降,最终抑制造血功能,导致贫血和中性粒细胞减少。传统的CFU测定主要定量药物对菌落数量的影响,而不是抑制细胞增殖可能导致的菌落大小的影响。无法量化菌落大小的变化可能解释了为什么AZT在CFU检测中没有表现出高毒性,众所周知AZT会干扰患者的造血功能。相比之下,通过评估用于区分特定细胞群的细胞表面标记物的表达和通过绝对细胞计数的细胞增殖,HemaTox™检测方法可以检测细胞分化的变化。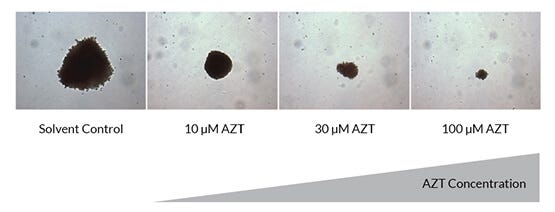
图5。在CFU实验中,通过菌落大小的变化可以定性地观察到AZT的强抗增殖作用
所示为在AZT缺失和AZT增加的情况下培养14天后,在CFU实验中,10倍放大的红系(BFU-E)菌落。
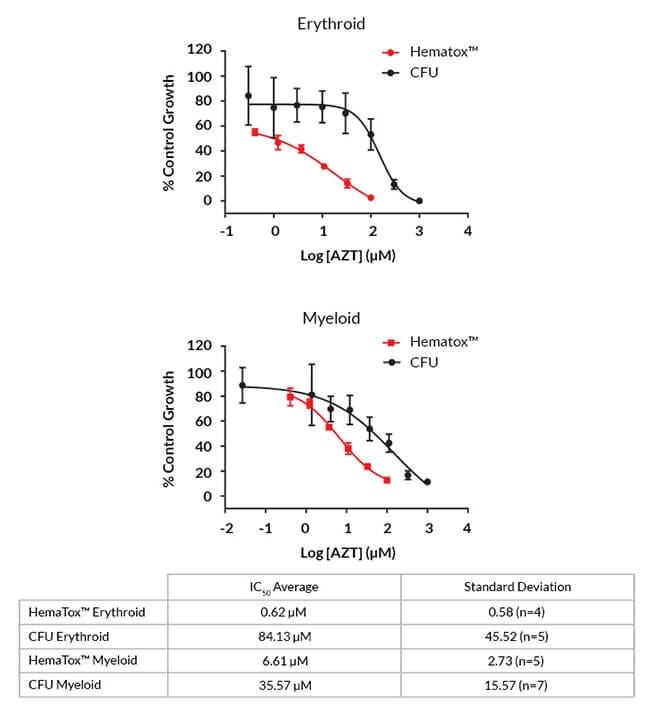
图6。与CFU检测相比,HemaTox™检测显示AZT的毒性更大
AZT的代表性剂量-反应曲线基于菌落数(黑色,CFU)和谱系特异性细胞数(红色,HemaTox™)。该表显示了平均IC50价值从3到5个多个捐赠批次和4到7个独立实验。
- 从人类脐带血或骨髓中提取合格的原代干细胞,提供高可重复性

图7。5-FU剂量-反应曲线在供体间和测定间的可重复性
将5-氟尿嘧啶添加到人CD34中进行滴定,生成剂量-反应曲线+5 - 7个供体批的细胞进行HemaTox™(A)髓系、(B)红系和(C)巨核细胞检测。在每个实验中,相似的IC50不同供体的细胞和同一供体的细胞在不同实验中得到的值。所示值(对照生长的百分比)与溶剂对照培养中的细胞数归一化。
间质毒性评估
合同化验服务执行的CFU-F化验
- 测量测试品对祖频率的影响
- 评估祖细胞的增殖或扩增潜力(菌落的大小和形态)
- 定量骨髓间充质祖细胞
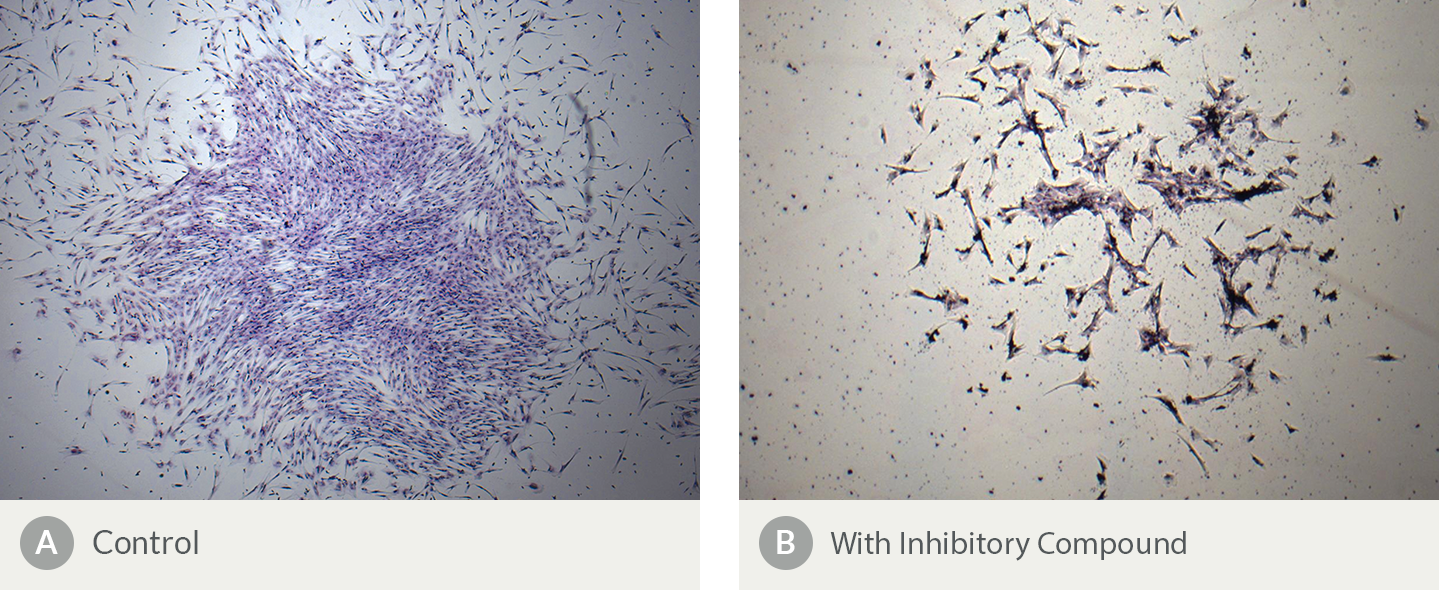
图8。抑制化合物的存在改变了人骨髓来源的CFU-F菌落的形态
图中显示的是集落形成单位-成纤维细胞(CFU-F)实验,其中MSCs在(A)不存在和(B)存在抑制化合物的情况下。形态学上的显著差异包括在含有(B)抑制化合物的培养物中较少的细胞和更分散的分布。菌落数量在抑制化合物的存在下也会减少(数据未显示)。
肠道类器官模型的毒性评价
通过使用3D培养系统,可以潜在地增加基于细胞的检测的生理相关性,弥合药物开发过程中高通量体外筛选方法和大型体内研究之间的差距。1,2肠道上皮生成的类器官在体内概括了成人肠道的许多特征,包括自我更新和分化途径、上皮内存在的细胞类型和细胞组织。这些特征共同创造了一个培养系统,是研究候选疗法对肠上皮的潜在毒性的有力工具。
Contract Assay Services提供了一种体外肠道类器官检测,通过测量细胞内ATP来评估候选疗法对细胞活力的影响。阅读更多关于细胞毒性化合物处理后小鼠小肠类器官细胞活力96孔测定方法的建立.
- Ranga A et al.(2014)基于干细胞的类器官模型的药物发现。Adv Drug delivery Rev 69-70 19-28。
- Sato T, Clevers H.(2013)从单个肠道干细胞培养自组织微型肠道:机制和应用。科学340(6137)1190-1194。









