StemSpan™造血细胞培养基和添加物
可再生造血干细胞和祖细胞分化与成熟
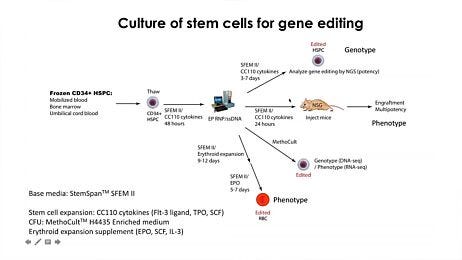
无血清培养系统StemSpan™造血细胞扩增培养基当补充了造血生长因子和/或用户选择的其他刺激时,促进正常或白血病人造血干细胞和祖细胞(HSPCs)的扩增,或其谱系特异性分化。StemSpan™扩增补充剂重组人细胞因子和其他添加剂的预混合鸡尾酒是否可以选择性地促进CD34的扩增+干细胞和祖细胞,或刺激其分化为红细胞、髓细胞(粒细胞或单核细胞)或巨核细胞祖细胞,当添加到StemSpan™培养基中时。完整的试剂盒,包括培养基,补充物和底物,允许CD34的扩增和谱系特异性分化+细胞在无基质条件下转化为T细胞或NK细胞。此外,结合培养基、补充物和小分子的试剂盒允许CD34的培养和扩增+从慢性髓性白血病(CML)或急性髓性白血病(AML)患者样本中分离的细胞。
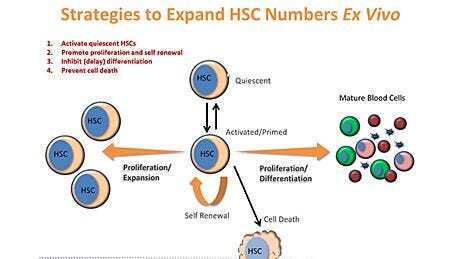
为什么使用StemSpan™介质和扩展补充剂?
- 组件经过精心挑选和筛选,以尽量减少批次之间的差异,始终提供最佳的培养条件。
- 培养基不含细胞因子,允许灵活添加StemSpan™扩展补充剂,细胞因子和/或添加剂。
- StemSpan™SFEM II,与适当的扩展补充相结合,支持CD34的更大扩展+红细胞,粒细胞,单核细胞和巨核细胞的细胞和分化,比其他培养基测试。
- 除了无血清和无xeno制剂,StemSpan™-AOF是第一种市售的用于培养HSPCs的无动物成分培养基。
cGMP造血干细胞扩增培养基
在进行造血细胞和基因治疗研究时,请考虑到临床。cGMP StemSpan-AOF通过去除造血细胞培养条件中的动物来源成分,可以帮助您顺利通过监管环境。StemSpan™-AOF仅含有重组蛋白和合成成分,并在经过认证的质量管理体系下按照相关的cgmp进行生产和测试。更多信息请访问STEMCELL >
- 人脐带血来源的CD34扩增20倍+培养7天后的细胞
- 原始CD34的维持明亮的CD90+CD45RA-文化中的人口
- 适合用于基因组编辑协议
- 不含动物成分和酚红配方
- 按照相关cgmp生产和检测
- 原料完全可追溯性
优点:
数据
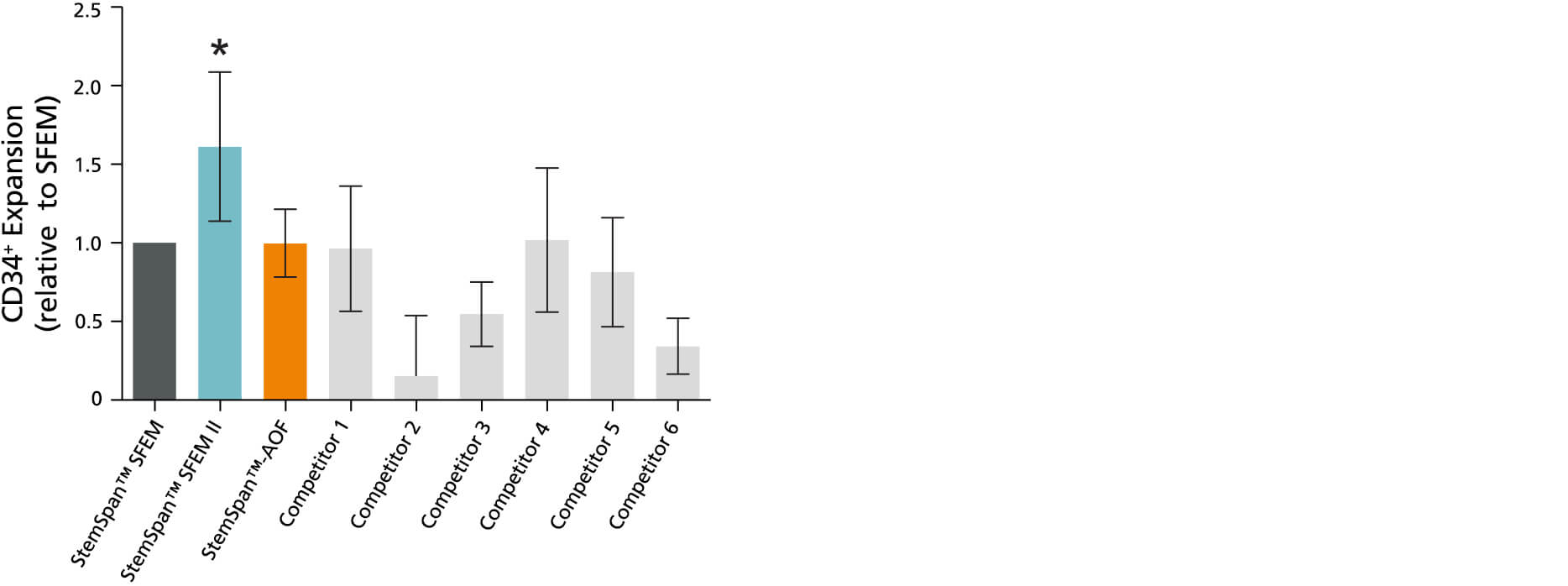
图1所示。StemSpan™SFEM II含CC100细胞因子鸡尾酒的无血清扩增培养基支持人类CD34的更大扩增+细胞比其他介质测试
CD34扩增+相对于StemSpan™SFEM培养基(深灰色条)中培养纯化后获得的值归一化的细胞+在StemSpan™SFEM、SFEM II和AOF以及其他商业供应商的六种培养基中培养CB细胞7天(浅灰色条;竞争对手1 - 6,包括StemLine II (Sigma)、HPGM(龙沙)、HP01 (Macopharma)、SCGM (Cellgenix)、StemPro34 (Life Technologies)和X-Vivo-15(龙沙)。所有培养基补充StemSpan™CC100细胞因子鸡尾酒(Cat #02697)。竖线表示95%置信限,95%的结果落在这个范围内。除StemSpan™-AOF产生的CB细胞数量外,StemSpan™SFEM II产生的细胞数量显著高于其他所有培养基(*p<0.05,配对t检验,n = 6)。
注:显示的StemSpan™-AOF数据是用原始含酚红版本(目录#09855)生成的。然而,内部测试表明,新的无酚红,cgmp制造版本的StemSpan™-AOF(目录#100-0130)的性能是可比的。
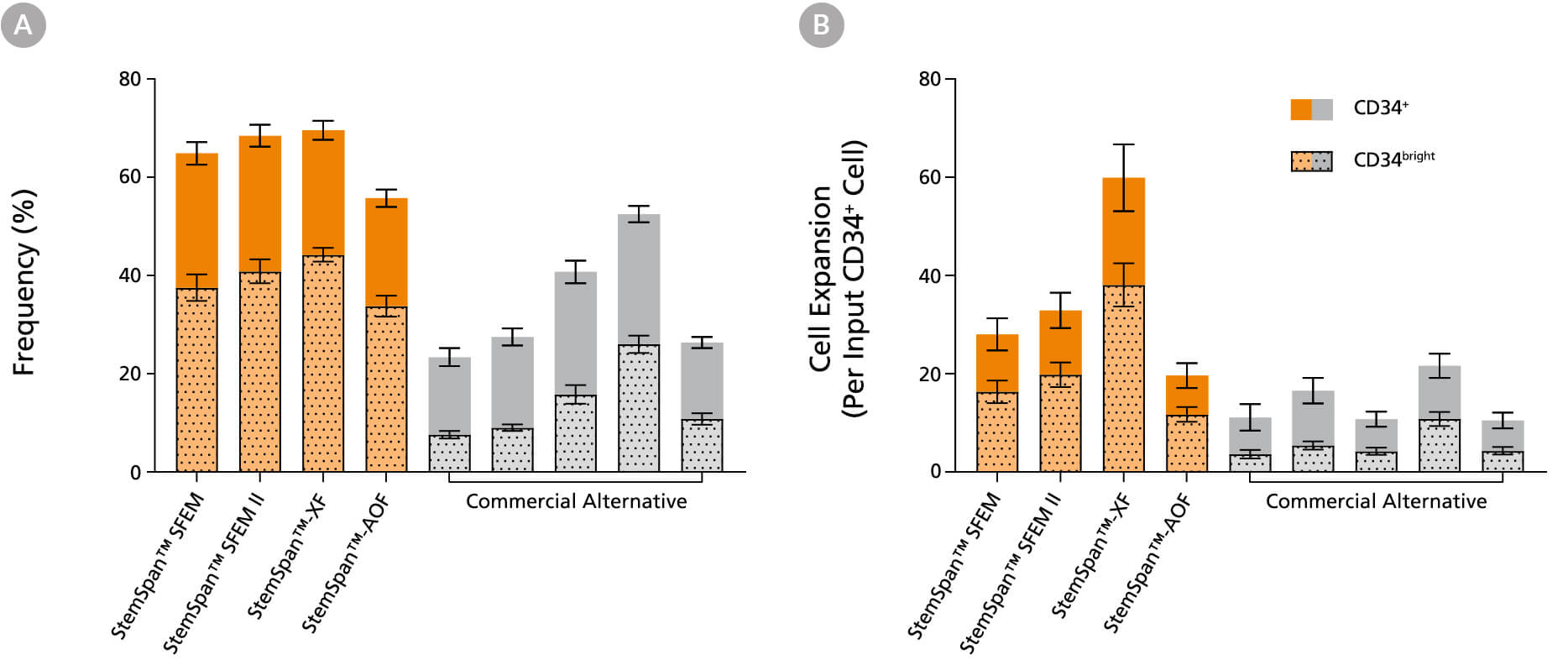
图2。StemSpan™媒体支持人类CD34的进一步扩展+和CD34明亮的细胞比其他商业媒体
纯化的cb衍生CD34+细胞在StemSpan™培养基(SFEM、SFEM II、AOF和XF,橙色条)和其他供应商的五种培养基(Commercial Alternative,灰色条)中培养7天。所有培养基补充StemSpan™CD34+扩展补充和UM171*。(A)活细胞CD34的频率和(B)细胞扩增+和CD34明亮的用流式细胞术分析培养细胞,如图1所示。与测试的商业替代品相比,StemSpan™培养基显示出明显更高的CD34扩增率+和CD34明亮的将StemSpan™SFEM、SFEM II和XF与其他供应商的五种培养基进行比较时,P < 0.05,使用单向方差分析和Dunnett事后检验计算)。CD34的明亮的细胞群中功能干细胞/祖细胞丰富(见图4)。所示数据为平均值±SEM (n = 8)。
*当使用最终浓度为1μM的UM729(目录#72332)时,预计会出现类似的结果。欲了解更多信息,包括UM171和UM729的比较数据,请参见Fares et al. 2014。
注:显示的StemSpan™-AOF数据是用原始含酚红版本(目录#09855)生成的。然而,内部测试表明,新的无酚红,cgmp制造版本的StemSpan™-AOF(目录#100-0130)的性能是可比的。

图3。StemSpan™SFEM II培养基中7天扩增动员外周血CD34 +细胞的流式细胞术分析
纯化CD34+从G-CSF动员的外周血(mPB)中提取的细胞在StemSpan™SFEM II培养基(目录号100-0130)中添加StemSpan™CD34培养7天+扩展补充(目录#02691)和UM729(目录#72332)。7天后,用荧光标记的CD34、CD45RA、CD90、EPCR和CD133抗体以及活力染料Zombie Yellow™对培养细胞进行染色,并用流式细胞术进行分析。CD34和FSC图上的水平虚线(左)表示CD34标记表达的荧光减一(FMO)对照。顺序门(橙色)用于测定活CD34的百分比明亮的细胞CD34明亮的CD90 + CD45RA -细胞+ CD34明亮的CD45RA⁻CD90 + CD133 + EPCR +细胞如图2、3、4所示。

图4。与其他商业媒体相比,StemSpan™媒体支持同等或更大的动员外周血造血干细胞扩展
纯化CD34+从G-CSF动员的外周血(mPB)中提取的细胞在StemSpan™培养基(SFEM, SFEM II, AOF和XF,橙色条)中以每mL 10000个细胞的浓度培养,并在其他供应商的六种培养基(商业替代品,灰色条)中培养。所有培养基补充StemSpan™CD34+扩展补充和UM729 (1uM)。培养7 d后,(A)活细胞CD34的频率和(B)细胞扩增率明亮的, CD34明亮的CD90 +和CD34明亮的CD45RA⁻CD90 + CD133 + EPCR +细胞采用流式细胞术分析,如图1所示。折叠扩展归一化为StemSpan™SFEM(上面的条形数字表示每个输入CD34的平均产量+细胞±SEM)。与测试的竞争对手介质相比,StemSpan™介质支持类似或更高的CD34扩增明亮的, CD34明亮的CD90 +和CD34明亮的CD45RA⁻CD90 + CD133 + EPCR +细胞(每个后续的细胞亚群逐渐被功能干细胞/祖细胞富集)所示数据为平均值±SEM (n=5)。

图5。使用极限稀释移植试验估算脐带血中CD34 +细胞在StemSpan™-AOF或StemSpan™SFEM II中扩增
纯化的脐带血来源的CD34 +细胞在StemSpan™-AOF或StemSpan™SFEM II中添加StemSpan™CD34 +扩增剂和UM729 (1 μM)培养7天。扩增7天后,将10、100、250和2500个初始CD34 +细胞的子代静脉注射到亚致死辐照的NSG小鼠体内。未培养的CD34 +分别移植250、500和2500个细胞。移植后约20周,在骨髓中测量表达泛白细胞标记CD45的人细胞的频率。采用>0.1%的CD45 +细胞阈值来考虑小鼠的移植是阳性还是阴性。极限稀释分析采用ELDA软件沃尔特和伊丽莎·霍尔医学研究所的软件每种情况下,LT-HSC频率(红线)和95%置信区间(框)表示为1/原始CD34 +细胞数(相当于第0天);N = 2个独立实验,每组2-7只。显著性水平* p< 0.001(卡方检验)。与新鲜CD34 +细胞相比,StemSpan™SFEM II和StemSpan™-AOF扩增后的细胞的lc - hsc增加了36倍和17倍,StemSpan™SFEM II、StemSpan™-AOF和新鲜对照的SRC频率分别为1/23、1/48和1/835。
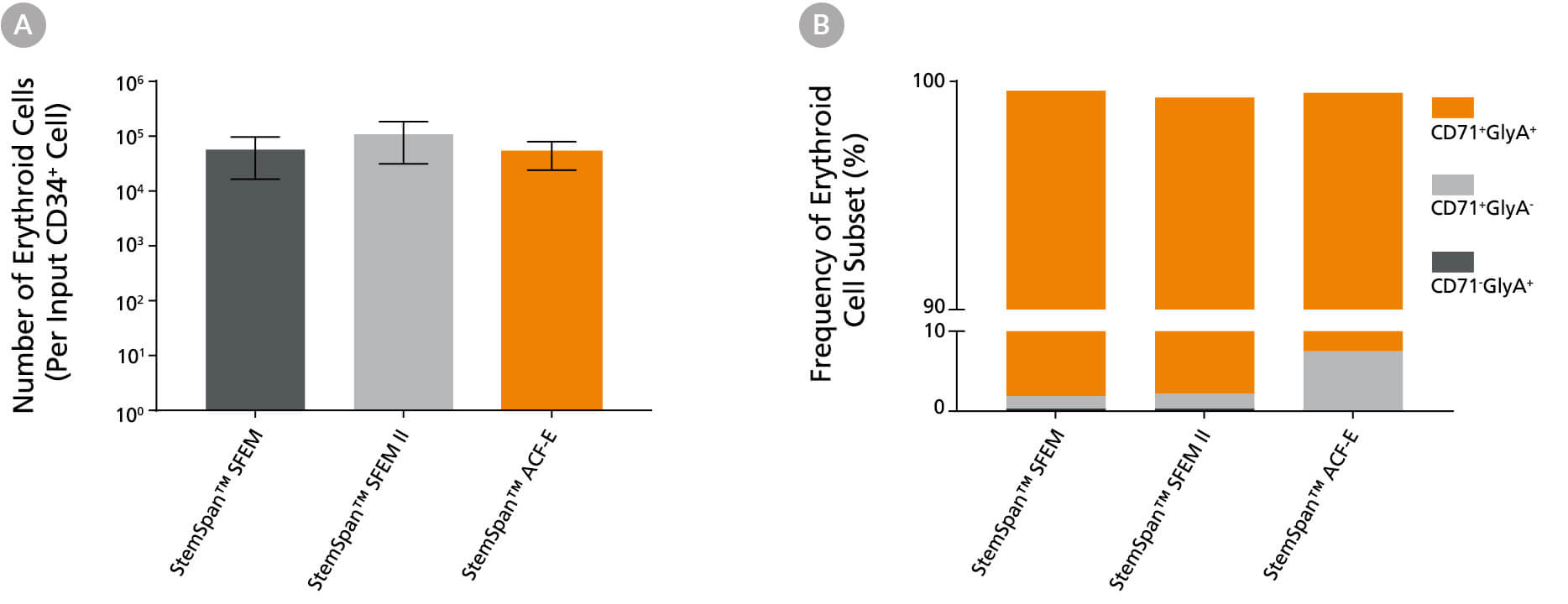
图6。StemSpan™SFEM II无血清扩增培养基含有红系扩增补充支持红系细胞比其他培养基更大的扩增
(A)纯化CD34培养后产生的红细胞平均数量+CB细胞(n = 5)在StemSpan™SFEM(黑色条形图)、SFEM II(灰色条形图)或StemSpan™-ACF红细胞扩增培养基(ACF-E,橙色条形图)中培养14天,培养基中含有StemSpan™红细胞扩增补充剂(目录#02692)。所示为每输入CD34表达CD71和/或Glycophorin A (GlyA)的红细胞数量+细胞。(B)显示了在这些培养中产生的不同红细胞亚群的百分比,包括CD71+GlyA+红细胞,未成熟CD71+GlyA-红细胞祖细胞和前红细胞,以及CD71-/ lowGlyA+正常红细胞。所有三种培养基都支持每个cb来源的CD34产生数千个红细胞+细胞板。
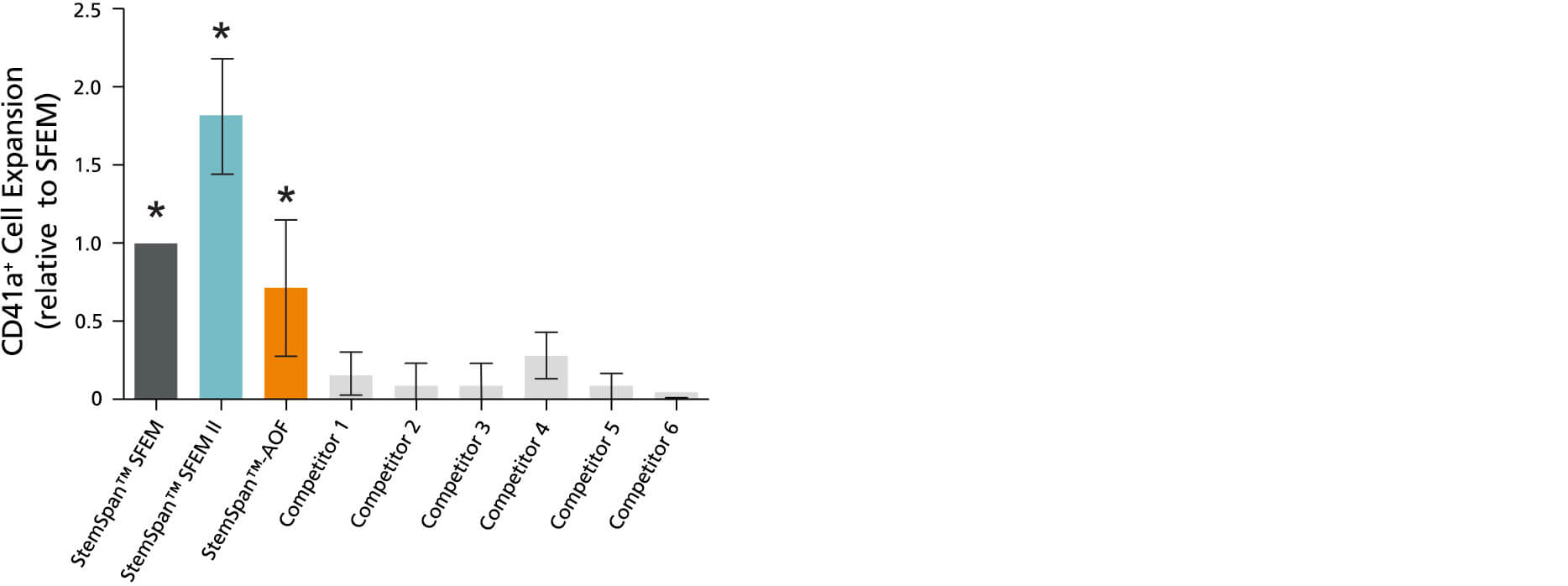
图7。StemSpan™SFEM II无血清扩增培养基含有巨核细胞扩增补充剂支持比其他培养基更大的巨核细胞扩增
纯化CD34培养后获得的巨核细胞数量,相对于StemSpan™SFEM培养基(深灰色条)中获得的值归一化+CB细胞在StemSpan™SFEM、SFEM II(金条)和AOF(橙色条)以及来自其他商业供应商的六种培养基(浅灰色条)中培养14天;竞争对手1-6,包括StemLine II (Sigma)、HPGM(龙沙)、HP01 (Macopharma)、SCGM (Cellgenix)、StemPro34 (Life Technologies)和X-Vivo-15(龙沙)。所有培养基补充StemSpan™巨核细胞扩增补品(目录#02696)。竖线表示95%置信限,95%的结果落在这个范围内。StemSpan™培养基中产生的细胞数量显著高于其他培养基(*p<0.01配对t检验,n=6)。
注:显示的StemSpan™-AOF数据是用原始含酚红版本(目录#09855)生成的。然而,内部测试表明,新的无酚红,cgmp制造版本的StemSpan™-AOF(目录#100-0130)的性能是可比的。
表1。人cbcd34产生髓系细胞+在含有髓细胞扩增剂或髓细胞扩增剂的SFEM II中培养的细胞

所示为每个输入的人cb来源的CD34产生的总有核细胞(TNCs)的数量+在含有髓细胞扩增剂(n = 14)或髓细胞扩增剂II (n = 16)的SFEM II中培养14天后,细胞和骨髓标记物CD13、CD14和CD15阳性的细胞百分比。*95%置信限(CL);95%的结果通常落在这个范围内。
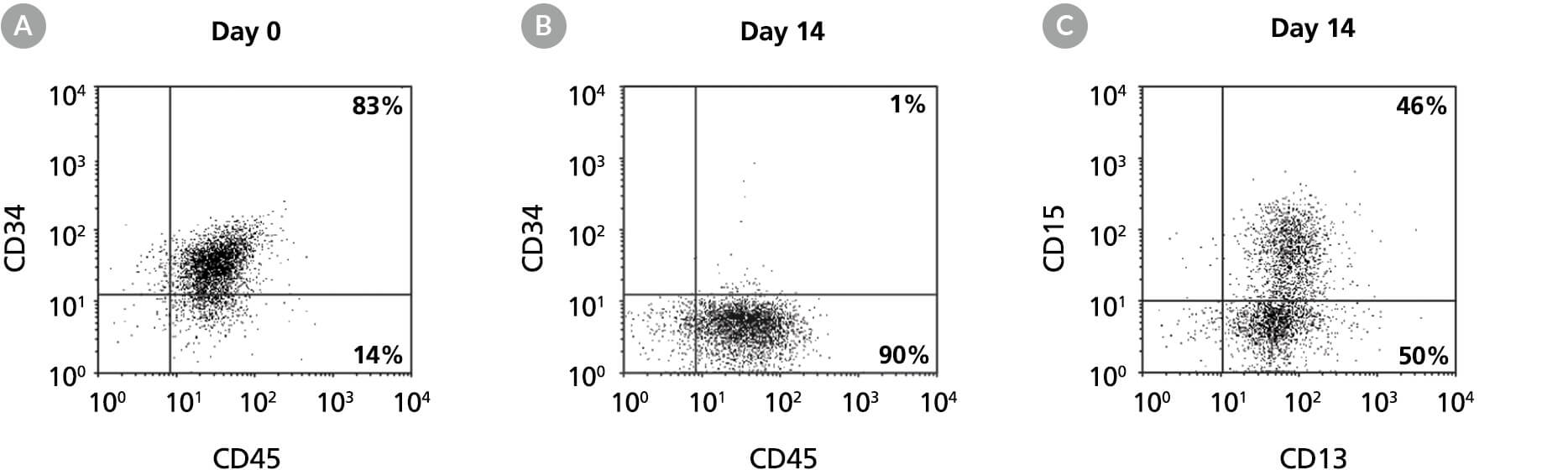
图8。CD13的产生+和CD15+StemSpan™SFEM II中含有髓细胞扩增剂的人脑源性细胞的扩增和谱系特异性分化
人脑源性CD34培养14天的流式细胞术点图+在StemSpan™SFEM II中含有髓细胞扩增补充剂的细胞在培养前和培养后14天(B)分别表达HSPC标记CD34和泛造血标记CD45 (A),培养后14天表达髓细胞标记CD13和CD15 (C)。CD34的频率+细胞从培养前的83%下降到培养14天后的~1%。同时,髓细胞CD13+CD15+细胞从第0天的<10%逐渐积累到第14天的46%。CD14的频率+培养后细胞数量低(通常<10%)。
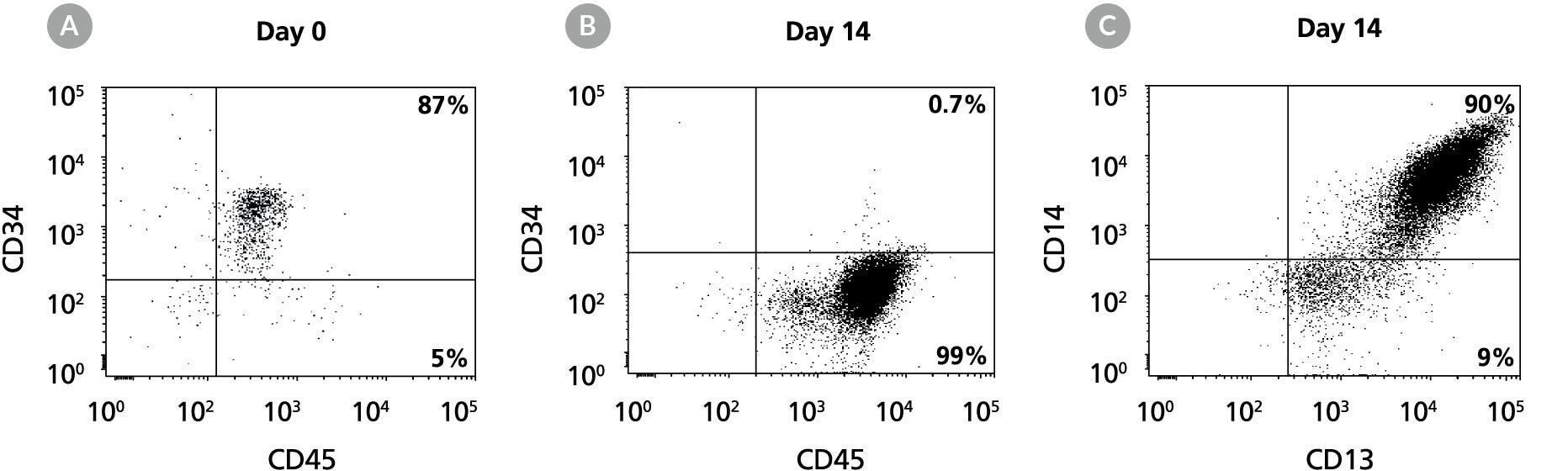
图9。CD14的产生+人cbcd34扩增和谱系特异性分化的单核细胞+StemSpan™SFEM II中含有髓系扩增物的细胞培养
人CD34细胞培养14天的流式细胞术点图+StemSpan™SFEM II中含有髓系扩增补充物II的细胞。图中显示了CD34和CD45在培养前(A)和培养后(B)的表达情况,以及CD13和CD14在扩增细胞上的表达情况。CD34的频率+细胞从培养前的87%下降到培养14天后的1%以下。CD14+单核细胞从第0天的< 5%增加到第14天的90%。
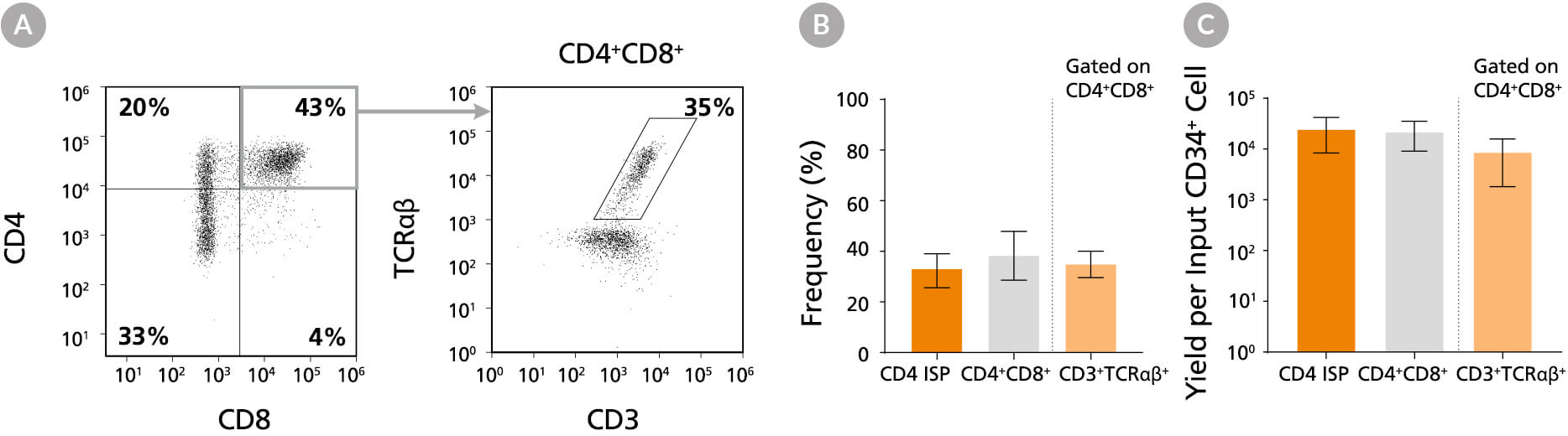
图10。CD4 ISP和CD4的频率和产率+CD8+培养42天后的DP细胞
CB-derived CD34+细胞(新鲜分离或冷冻)用StemSpan™T细胞生成试剂盒(目录#09940)培养42天,(A)通过流式细胞术分析CD4、CD8、CD3和TCRαβ的表达。(B) CD4 ISP的频率和(C)产率,双阳性(CD4+CD8+)和CD3+细胞受体αβ+-表达双阳性细胞(CD4+CD8+CD3+细胞受体αβ+)所示。DP (CD4)细胞平均占总活菌群的38%++),其中35%共表达CD3和TCRαβ。总DP细胞和CD3的产率+细胞受体αβ+DP细胞每输入CD34+细胞数分别为~23,000和~9,000。所示为95%置信区间的平均值(n = 31)。
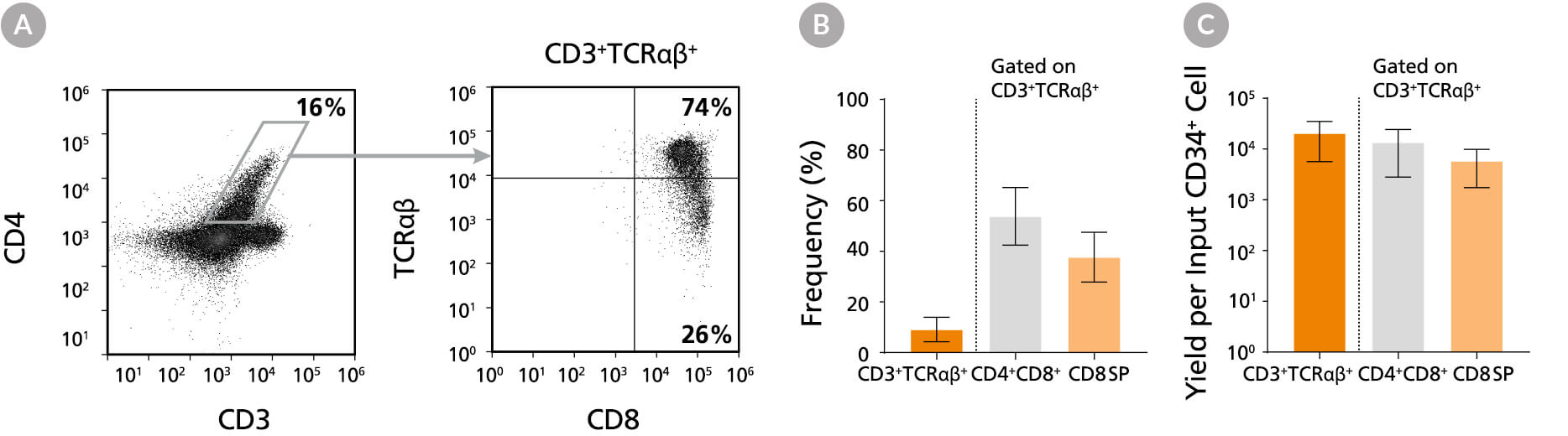
图11。培养49天后CD8 SP T细胞的频率和产量
通过在StemSpan™SFEM II中添加T细胞祖细胞成熟补充剂(目录#09930)、IL-15(目录#78031)和ImmunoCult™CD3/CD28/CD2 T细胞激活剂(目录#10970),在涂膜板上再培养7天,DP细胞进一步成熟为CD8 SP T细胞。第49天,流式细胞术(A)检测细胞CD3、TCRαβ、CD4和CD8的表达。CD3的(B)频率和产率+细胞受体αβ+-表达细胞及其子集。平均有54%的CD3+细胞受体αβ+细胞DP (CD4)+CD8+CD8 SP (CD4)占38%-CD8+). 每个输入CD34的CD8 SP T细胞的平均产量+细胞为~ 6000。CD3+细胞受体αβ+Cd4 sp (Cd4+CD8-) T细胞的检测频率非常低(数据未显示)。所示为95%置信区间的平均值(n = 12)。
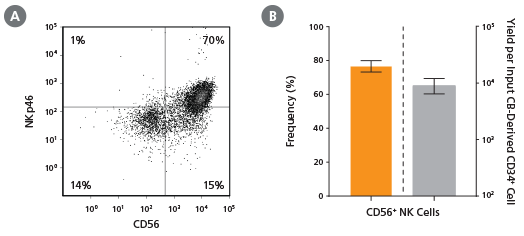
图12。CD56的频率和产率+培养28天后的NK细胞
CB-derived CD34+细胞(新鲜分离或冷冻)用StemSpan™T细胞生成试剂盒(目录#09940)培养42天,(A)通过流式细胞术分析CD4、CD8、CD3和TCRαβ的表达。(B) CD4 ISP的频率和(C)产率,双阳性(CD4+CD8+)和CD3+细胞受体αβ+-表达双阳性细胞(CD4+CD8+CD3+细胞受体αβ+)所示。DP (CD4)细胞平均占总活菌群的38%++),其中35%共表达CD3和TCRαβ。总DP细胞和CD3的产率+细胞受体αβ+DP细胞每输入CD34+细胞数分别为~23,000和~9,000。所示为95%置信区间的平均值(n = 31)。
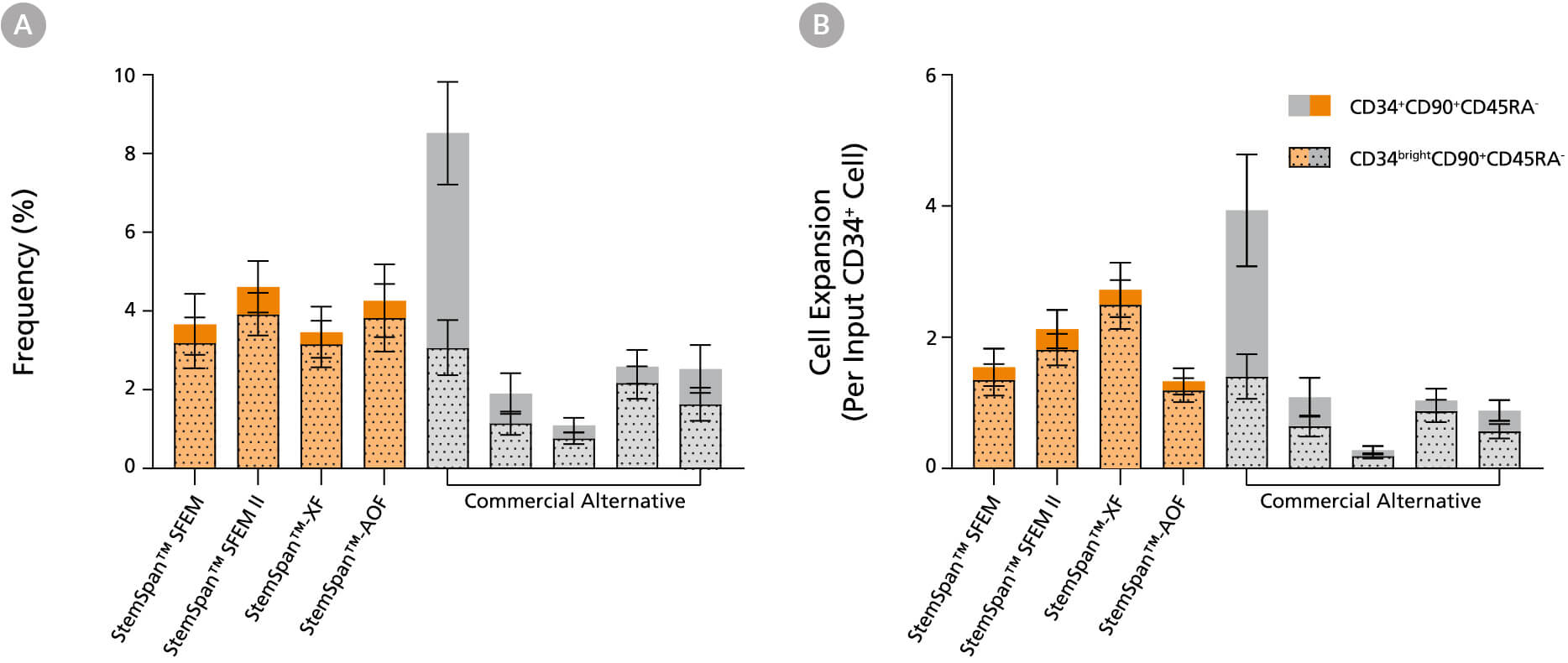
图13。StemSpan™媒体支持原始人类CD34同等或更高的扩增明亮的CD90+CD45RA-细胞比其他商业媒体
纯化的cb衍生CD34+细胞在StemSpan™培养基(SFEM、SFEM II、AOF和XF,橙色条)和其他供应商的五种培养基(Commercial Alternative,灰色条)中培养7天。所有培养基补充StemSpan™CD34+扩展补充和UM171*。(A)活细胞CD34的频率和(B)细胞扩增+CD90+CD45RA-(固体)和CD34明亮的CD90+CD45RA-(虚线覆盖)用流式细胞术分析培养细胞,如图1所示。与竞争对手的培养基相比,StemSpan™培养基显示出相似或显著更高的CD34扩增明亮的CD90+CD45RA-将StemSpan™SFEM II和XF与其他供应商的五种培养基进行比较时,P < 0.05,使用单向方差分析和Dunnett事后检验计算)。CD34的明亮的CD90+CD45RA-功能干细胞/祖细胞的细胞群高度富集。所示数据为平均值±SEM (n = 8)。
*当使用最终浓度为1μM的UM729(目录#72332)时,预计会出现类似的结果。欲了解更多信息,包括UM171和UM729的比较数据,请参见Fares et al. 2014。
注:显示的StemSpan™-AOF数据是用原始含酚红版本(目录#09855)生成的。然而,内部测试表明,新的无酚红,cgmp制造版本的StemSpan™-AOF(目录#100-0130)的性能是可比的。
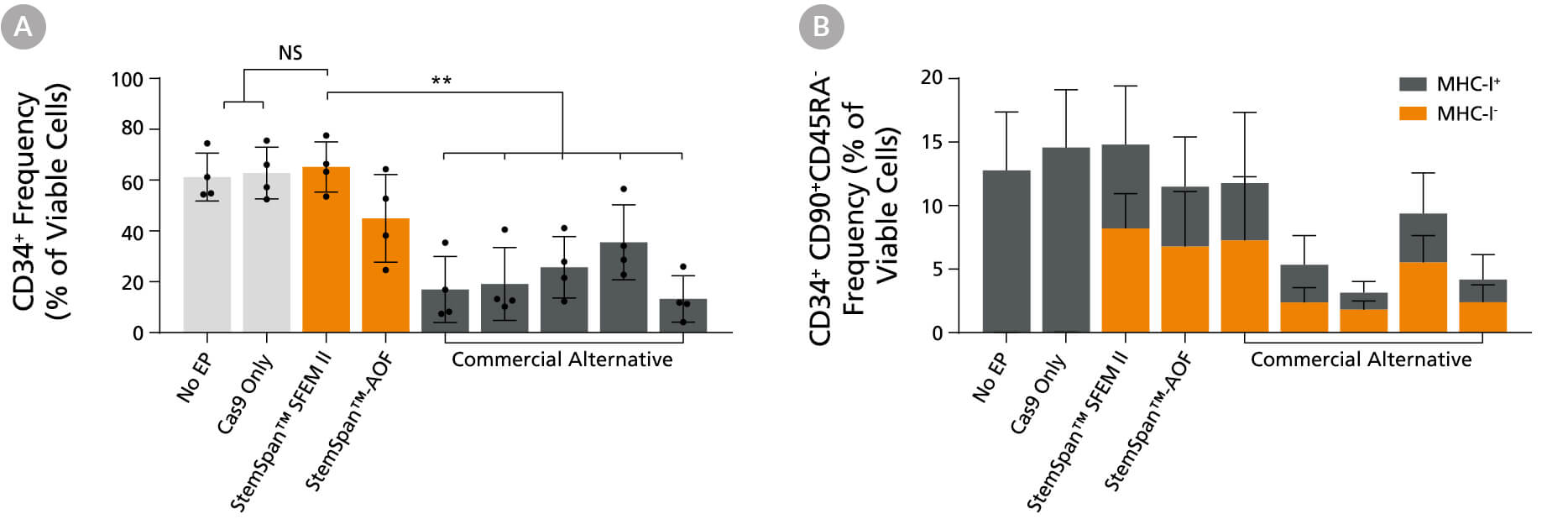
图14。StemSpan™媒体支持更好的CD34+和原始CD34+CD90+CD45RA-HSPC在基因组编辑应用中的扩展与替代商业媒体的比较
纯化的cb衍生CD34+细胞在选定的StemSpan™培养基(StemSpan™SFEM II或StemSpan™-AOF,橙色条)或其他供应商提供的五种无xeno培养基配方(灰色条)中培养2天。所有培养基补充StemSpan™CD34+扩展补充和UM171*。然后使用含有crRNA:靶向β -2微球蛋白(B2M)的tracrRNA的architect™CRISPR-Cas9 RNP复合物电穿孔细胞,并在相同条件下再培养4天。通过MHC-I染色和流式细胞术分析,敲除效率在所有培养基中都是相似的,约为70-80%。(A) CD34的百分比+(B) CD34+CD90+CD45RA-电穿孔后4 d流式细胞术定量细胞。所示数据为平均值+标准差(n = 4个供体;** p < 0.01)。
*当使用最终浓度为1 μM的UM729(目录#72332)时,预计会出现类似的结果。欲了解更多信息,包括UM171和UM729的比较数据,请参见Fares et al., 2014。
注:显示的StemSpan™-AOF数据是用原始含酚红版本(目录#09855)生成的。然而,内部测试表明,新的无酚红,cgmp制造版本的StemSpan™-AOF(目录#100-0130)的性能是可比的。

图15。CD34的集落形成潜能+CML细胞在培养过程中得到维持
CD34后直接使用MethoCult™H4435富集培养基进行CML细胞集落检测+细胞分离(第0天)或在没有或有UM171的情况下扩增7天或14天后(如图2所示)。在StemSpan™SFEM II中加入CD34培养14天后+扩增补充物(Exp)含或不含UM171,菌落(A)用STEMvision™成像,并从数字图像中手动计数。(B) CFU输出以每个原始输入CD34的菌落总数表示+细胞。每个单独条形图上方的数字表示BCR-ABL阳性菌落的比例,通过qRT-PCR对6个不同样品的单个采摘菌落进行测量(每种条件下每个样品采摘8-12个菌落)。SFEM II补充CD34+扩展补充剂(Exp)支持培养中集落形成祖细胞的扩展。UM171进一步促进集落形成的祖细胞输出(在第7天和第14天扩增~3.5倍)。单菌落qRT-PCR分析显示,从第0天的样品中产生的菌落,以及从扩增7天和14天的细胞中产生的菌落,主要是BCR-ABL+还有正常的BCR-ABL-祖细胞以低频率存在。所示数据为平均值±SEM (n = 6)。P值采用双尾配对Student’s t检验计算(*P < 0.05)。

图16。CD34的集落形成潜能+AML细胞在培养过程中得以维持
AML细胞,CD34后+细胞分离(第0天)或在无UM171或有UM171的情况下扩增7天或14天后(如图3所示),用MethoCult™H4435富集培养基进行菌落测定。孵育14天后,用STEMvision™对菌落进行(A)成像,并从数字图像中手动计数。(B) CFU输出以每个原始输入CD34的菌落总数表示+细胞。SFEM II补充CD34+扩展补充剂(Exp)支持培养中集落形成祖细胞的扩展。添加UM171进一步促进了集落形成祖细胞的输出(第7天和第14天分别增加了3倍和4倍)。所示数据为平均值±SEM (n = 6)。P值采用双尾配对Student’s t检验计算(*P < 0.05)。
科学资源
关键应用程序
体外成熟血细胞的生成
Leberbauer et al. (2005)不同甾体激素共同调控人红细胞祖细胞的长期扩增和终末分化。105年血(1)
随机二世
Huijskens et al. (2014)技术进步:抗坏血酸诱导人造血干细胞在缺乏基质细胞的情况下产生双阳性T细胞。中华生物医学杂志,1996 (6)
CC100
Kumkhaek et al. (2013)MASL1诱导人促红细胞生成素依赖性CD34的红细胞分化+通过Raf/MEK/ERK通路血121 (16)
CC110
Gaikwad et al. (2007)真性红细胞增多症患者红细胞祖细胞的体外扩增导致JAK2V617F等位基因的降低。Exp Hema 35(4)
造血干细胞体外扩增用于移植后快速/持续的造血恢复
生成靶细胞重编程制备诱导多能干细胞
Ohmine et al. (2011)从gmp级造血祖细胞和单核髓细胞诱导多能干细胞。干细胞研究与治疗2(6)
基因转移到HSPCs
Lechman et al. (2012)miR-126活性的衰减在体内扩展HSC而不耗尽。干细胞11(6)
随机二世
Buechele C等人(2015)人CD34+造血细胞基因组编辑诱导MLL白血病。血。打印前Epub