使用STEMdiff™培养基从人多能干细胞生成单核细胞
- 文档 #27226
- 版本 1.0.1
- 2023年10月
背景介绍
单核细胞是先天性免疫系统的重要组成部分,由于其具有分化为巨噬细胞和树突状细胞的能力,可对病原体或肿瘤进行防御。 虽然单核细胞可以从外周血中分离出来,但人多能干细胞(hPSCs)提供了另一种潜在的、无限的单核细胞来源。 这些hPSC衍生的单核细胞可用于疾病建模、细胞治疗应用的开发和基础生物学研究。
STEMdiff™单核细胞试剂盒用于将hPSCs在无饲养层和无血清的培养条件下分化为单核细胞。
将hPSCs分化为单核细胞
STEMdiff™单核细胞试剂盒用于将hPSCs分化为单核细胞的三个胚层,如图1所示。 在第1阶段,培养3天后,使用培养基A将hPSCs分化为中胚层。 第2阶段,将细胞在培养基B中培养4天,促进其定向分化为造血祖细胞。 在第3阶段,使用单核细胞分化培养基促进祖细胞向单核细胞分化。 这些可以通过CD14的表达来识别,如图2所示。 STEMdiff™单核细胞试剂盒经过优化,可用于在TeSR™培养基中维持培养的多种胚胎干(ES)和诱导多能干(iPS)细胞系的分化。 分化后,hPSC衍生的单核细胞可用于其他下游检测。
使用STEMdiff™生成单核细胞的优势
- 在短短14-23天内,每板可生成多达700万个CD14+单核细胞。
- 通过使用无血清和无饲养条件,消除由血清和饲养细胞引入的变异。
- 使用简单的单层培养方式生成单核细胞,便于收获悬浮细胞。
- 适配用于多种hES和hiPS细胞系。
| 产品名称 | 规格 | 货号 # |
|---|---|---|
| STEMdiff™ 巨核细胞试剂盒 | 1 套 | 100-0900 |
| 试剂盒组分 | 规格 | 货号 # |
| STEMdiff™ 造血基础培养基 | 120 ml | 05311 |
| STEMdiff™ 造血添加物 A (200X) | 225 μl | 05312 |
| STEMdiff™ 巨核细胞添加物 MK 1 (10X) | 10 ml | 100-0901 |
| STEMdiff™ 巨核细胞添加物 MK 2 (10X) | 10 ml | 100-0902 |
| StemSpan™ SFEM II | 100 ml | 09605 |
生成巨核细胞实验方案
建议使用以下方案对 mTeSR™1、mTeSR™ Plus 或 TeSR™-AOF™ 中保存的 hPSC 进行扩增和巨核细胞分化。
使用此方案,每接种一个 hPSC 的细胞可获得 223 - 425 个 CD41a⁺ CD42b⁺ 巨核细胞,纯度范围为 56 - 77%。实验之间的细胞得率和比例可能会有所不同,具体取决于细胞系和分化培养开始时细胞的状况。 根据您的具体目标,可能需要进一步优化方案(例如测试不同的铺板密度、培养周期、以及补充培养基和重铺板频率)。

图 1. 巨核细胞分化方案
17 天的方案包括两个主要阶段:12 天的阶段,用于将人胚胎干 (hES) 或诱导多能干 (hiPS) 细胞分化为偏巨核细胞的造血祖细胞 (HPC),以及 5 天的阶段。阶段进一步将 hES 或 hiPS 细胞衍生的 HPC 分化为成熟的巨核细胞 (MK)。 在第-1天,hES或hiPS细胞以聚集体的形式铺板(直径100-200μm,每个聚集体约100个细胞),按密度在mTeSR™1、mTeSR™ Plus 或 TeSR™-AOF 中为 10 ‑ 20 个聚集体/cm2铺板在 Corning® Matrigel® 包被的培养板上 。 贴壁过夜并确认贴壁克隆数在4-10克隆/cm2以内,中胚层通过用培养基 A(STEMdiff™ 造血基础培养基 + STEMdiff™ 造血添加物 A)替换 TeSR™ 培养基来诱导。 第 3 天,培养基更换为培养基 MK1 (STEMdiff™ 造血细胞基础培养基 + STEMdiff™ 巨核细胞添加物 MK1) 用于内皮细胞向造血转化 (EHT) 和造血表征。 在此阶段,hES 或 hiPS 细胞衍生的 HPC 从内皮细胞粘附层中被释放到悬浮液中。 第 12 天,收获悬浮液中的 HPC,并以 1 - 3.5 x 105 细胞/mL 培养5天以产生成熟的MK。
该程序已针对人 ES 和 iPS 细胞的使用进行了优化; 请参阅产品说明书(PIS;文档号 10000013343)了解完整说明。
1. 根据 PIS 中的方案,对 hPSC 传代进行聚合和分化设置。
注意:有关维持高质量人 ES 和 iPS 细胞以及用 Corning® Matrigel® 包板的完整说明,请参阅 mTeSR™1、mTeSR™ Plus 或 TeSR™ E8™ 技术手册,可在 www.stemcell 上获取 .com, 或联系我们索取电子版本。
造血分化实验方案
注意:在整个实验过程中,使用前将所有培养基预热至室温 (15 - 25°C)。 请勿将培养基长时间置于室温下。
- 在第 0 天,确认 16 - 40 个克隆/孔粘附在培养皿上(4 - 10 个克隆/cm²;该方案基于 12 孔板,但可以适应其他培养皿尺寸)。 从孔中吸出培养基。
- 每孔添加 1 mL 培养基 A(STEMdiff™ 造血基础培养基 + STEMdiff™ 造血添加物 A)。 将剩余的培养基 A 储存在 2 - 8°C 下直至下次使用。
- 在 37°C 和 5% CO2 下孵育 2 天。
- 第 2 天,从每个孔中轻轻取出 0.5 mL 培养基并丢弃。 每孔轻轻添加 0.5 mL 培养基 A。
- 37°C 孵育 24 小时。
- 第 3 天,从孔中吸出培养基。 每孔轻轻添加 1 mL 培养基 MK1(STEMdiff™ 造血基础培养基 + STEMdiff™ 巨核细胞添加物 MK1)。 将剩余的培养基 MK1 储存在 2 - 8°C 直至下次使用。
- 37°C 孵育 2 天。
- 根据 PIS,在第 5、7 和 10 天用培养基 MK1 进行全培养基更换,注意不要干扰悬浮的细胞群。
- 每次更换培养基后,在 37°C 下孵育 2 天。
- 第 12 天,按如下方式收获造血细胞:
- 上下吹打细胞以清洗孔并从贴壁细胞层中除去悬浮细胞。
- 将 1 mL StemSpan™ SFEM II 添加到孔中。 在孔中剧烈吹打并添加到收集管中。
- 对每个孔重复步骤 10a 和 10b。
- 在室温 (15 - 25°C) 下以 300 x g 离心收集管 5 分钟。
- 取出并丢弃上清液。
- 将细胞沉淀重悬于 StemSpan™ SFEM II 中,并使用台盼蓝和血细胞计数器进行活细胞计数。
巨核细胞分化实验方案
- 第 12 天,向组织培养处理的 12 孔板的每个孔中添加 1 mL 培养基 MK2(StemSpan™ SFEM II + STEMdiff™ 巨核细胞添加物 MK2)。
- 将收获的细胞(来自造血分化方案第 10 步)以 100,000 - 350,000 个细胞/mL 添加到每个孔中。
- 37°C 孵育 5 天。
- 第 17 天,按如下方式收获巨核细胞:
- 上下吹打细胞以清洗孔。
- 将细胞悬液转移至收集管中。
- 在室温 (15 - 25°C) 下以 300 x g 离心收集管 5 分钟。
- 取出并丢弃上清液。
- 将细胞沉淀重悬于所需培养基中,并进行活细胞计数以进行分析或下游测定。 CD41a+CD42b+巨核细胞群的纯度可以通过流式细胞术测定。
结果

图 2. 巨核细胞分化方案
按照图 1 中描述的方案,诱导 hES 和 hiPS 细胞分化为偏向巨核细胞-红细胞的 HPC。第 12 天,从上清液中收获细胞并分析 CD41a 的表达,通过流式细胞术检测 CD42b、CD34 和 GlyA。 通过光散射谱和碘化丙啶 (PI) 染色排除死细胞。 (A) 第 12 天 hES 衍生 (H9) 细胞的代表性流式细胞术图。显示高水平的 CD41a 和 CD42b 以及 CD34 和 GlyA 表达,表明该方案支持 hPSC 在第 12 天分化为巨核细胞-红系祖细胞。(B) 对于两个 hES 细胞系(H1 和 H9)和两个 hiPS 细胞系(WLS-1C 和 STiPS-R038),每个接种细胞分化的 CD41a⁺CD42b⁺ 细胞比例和得率。 第 12 天,活的 CD41a⁺ CD42b⁺ 细胞的平均比例在 33% 到 62% 之间。 平均每个接种细胞产生的 CD41a⁺CD42b⁺ 细胞的得率范围在 72 到 174 之间。数据显示为平均值 ± SEM(H1 为 n = 7,H9 为 n = 20,WLS-1C 为 n = 19,STiPS 为 n = 7 -R038)。
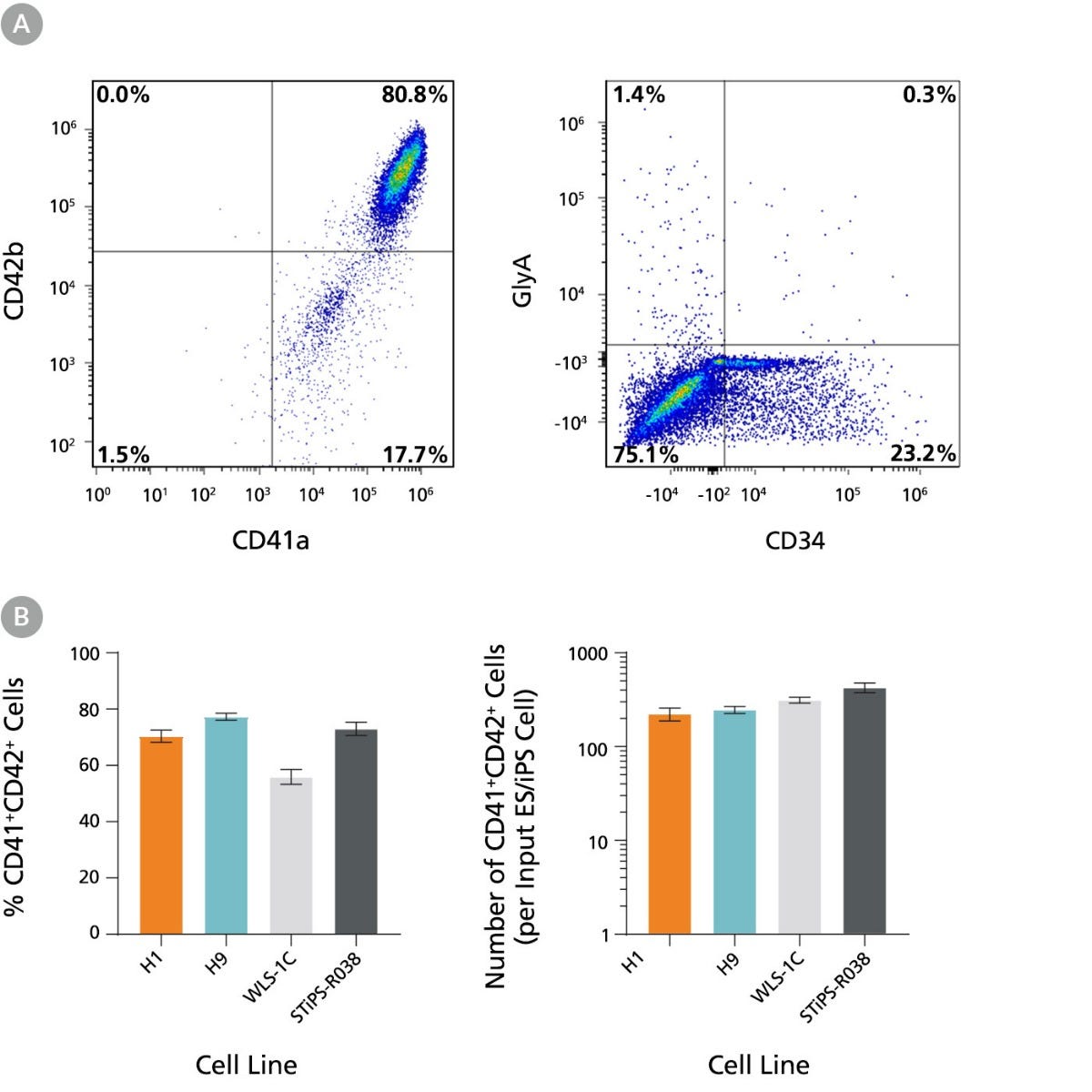
图 3. hPSC 衍生的 HPC 在另外 5 天的培养过程中有效扩增并分化为 CD41a+CD42b+ 巨核细胞
第 12 天的 hPSC 衍生 HPC 在 MK2 培养基中再培养 5 天,以按照图 1 中描述的方案促进分化为成熟 MK。收获细胞并通过流式细胞术检测 CD41a、CD42b、CD34 和 GlyA。 通过光散射谱和 PI 染色排除死细胞。 (A) 第 17 天 hES 衍生 (H9) 细胞的代表性流式细胞术图。细胞显示出高CD41a 和 CD42b 水平以及低 GlyA 和 CD34 标记物水平,表明分化为巨核细胞。 (B) 两个 hES 细胞系(H1 和 H9)的每个接种细胞产生的 CD41a⁺CD42b⁺ MK 的比例和得率,以及两种 hiPS 细胞系(WLS-1C 和 STiPS-R038)。 第 17 天,存活 CD41a⁺ CD42b⁺ 细胞的平均比例在 56% 到 77% 之间。 每个接种细胞生成的 CD41a⁺CD42b⁺ MK 的平均得率在 223 之间和 425。数据显示为平均值±SEM(H1 n = 12,H9 n = 29,WLS-1C n = 27,STiPS-R038 n = 12)。

图 4. 使用 STEMdiff™ 巨核细胞试剂盒生成的 hPSC 衍生巨核细胞是多倍体
使用 STEMdiff™ 巨核细胞试剂盒获得的 hPSC 衍生 MK 显示出成熟和成体样特征:细胞增大和多倍体化。 (A) 第 17 天拍摄的代表性图像,显示衍生的 MK来自 H1 细胞(10 倍放大)。 (B) 第 17 天拍摄的代表性免疫荧光图像显示源自 H1 和 WLS-1C 的 CD41a+ MK 是多倍体(分别放大 20 倍和 63 倍)。 细胞经过甲醛固定并用针对表面标记 CD41a(绿色)和 DAPI(蓝色)的荧光素偶联抗体进行染色。 (C) 第 17 天源自 H9 细胞的 MK 的代表性细胞涂片,显示高倍性(40 倍放大,May-Grunwald Giemsa 染色)。 (D) 代表性流式细胞术直方图和散点图,显示第 17 天源自 H9 细胞的乙醇固定 MK 的 DNA 倍性谱。通过PI染色的数量测定了 DNA 含量,直方图上的不同峰代表2N、4N和8N+细胞。 对 CD41a+ 细胞设门进行倍性分析。 (E) 两个 hES 细胞系产生的 MK 的倍性分布(H1 和 H9)和两种 hiPS 细胞系(WLS-1C 和 STiPS-R038)。 第17天时,2N、4N和8N+的CD41a+细胞的平均倍性分布分别为66%、24.5%和9.5%。 数据显示为平均值±SEM (n = 对于 H1,n = 6;对于 H9,n = 28;对于 WLS-1C,n = 19;对于 STiPS-R038,n = 10)。

图 5. 使用 STEMdiff™ 巨核细胞试剂盒生成 hPSC 衍生巨核细胞可产生血小板样颗粒
使用 STEMdiff™ 巨核细胞试剂盒获得的 hPSC 衍生 MK 能够形成前血小板,产生功能性血小板样颗粒 (PLP)。 (A) 第 17 天拍摄的代表性图像,显示 MK 衍生的H1 细胞形成前血小板(长胞质突起;10 倍放大)。 (B) 第 17 天的 MK 和 PLP 的代表性流式细胞术前向/侧向散射图以及源自 H9 细胞的 PLP 的直方图。PLP 门控基于从新鲜血液中制备的对照血小板 (PLT)。 细胞还用抗 CD41a、CD45 和 GlyA 的抗体进行染色,以进行 PLP 表征和计数。 PLP表现出高水平CD41a 表达(无 CD45 和 GlyA 表达;数据未显示)与对照 PLT 中相同。 灰色填充直方图代表 CD41a 荧光 (FMO) 对照。 (C) 第 17 天两种 hES 细胞系(H1 和 H9)和两种 hiPS 细胞系(WLS-1C 和 STiPS-R038)来源的每个 MK 生成的 PLP 数量。 PLP 和 MK 分别根据以 PLP 设门中 CD41a⁺ CD45⁻GlyA⁻ 细胞和以 MK 设门中活 CD41a⁺ 细胞的数量进行计数。每个 MK 生成的 PLP 的平均得率在 3.2 到 5.1 之间。 数据显示为平均值±SEM(H1 n = 12,H9 n = 28,WLS-1C n = 27,STiPS-R038 n = 12)。

图 6. STEMdiff™ 巨核细胞试剂盒比其他已发布的方案能产生更多的巨核细胞和血小板样颗粒
使用 STEMdiff™ 巨核细胞试剂盒并使用文献中四种不同的已发表方案(经过修改)将 hES 和 hiPS 细胞分化为 MK。 (A) 通过流式细胞术分析两种 hES 细胞系(H1 和 H9)和两种 hiPS 细胞系(WLS-1C 和 STiPS-R038)的来源的 CD41a⁺CD42b⁺ MK 的比例和得率,如图 2 所示。 (B) 计算每个接种细胞生成的 PLP 数量 如上所述如图 5 所示。与已发布的方案相比,STEMdiff™ 巨核细胞试剂盒每个接种细胞产生的 CD41a⁺CD42b⁺ MK 多 10 至 40 倍,PLP 多 6 至 23 倍。 Pp 值使用单向方差分析计算其次是 Dunnett 事后检验(*p < 0.05,**p < 0.01)。 数据显示为平均值±SEM (n = 7 - 8)。
产品信息
需要但不包括的材料
| 产品名称 | 货号 # |
|---|---|
| Hausser Scientific™ Bright-Line 血细胞计数器 | 100-1181 |
| mTeSR™1
或 mTeSR™ Plus 或 TeSR™-AOF |
85850
或 100-0276 或 100-0401 |
| Corning® Matrigel® hESC 基质 | 康宁 354277 |
| 温和的细胞解离试剂
或 ReLeSR™ 或 分散酶 (1 U/mL) |
100-0485
或 100-0484 或 07923 |
| 含有 15 mM HEPES 的 DMEM/F-12 | 36254 |
| 台盼蓝 | 07050 |
| 处理的12 孔组织培养板 | 例如 38052 |
| 96孔平底板 | 例如 38022 |
推荐用于分析的抗体
| 产品名称 | 货号 # |
|---|---|
| 抗人 CD41a 抗体,克隆 HIP8 | 60114 |
| 抗人 CD42b 抗体,克隆 HIP1 | 生物传奇 303912 |








