CRISPR-Cas9基因编辑人类肠道类器官
肠类器官是三维细胞培养,再现了成人肠上皮的细胞特征和组织。肠道类器官培养的一个关键好处是它们适合基因组编辑,例如CRISPR-Cas9,这是一种rna引导的技术,由于其简单和高效,已经彻底改变了基因组编辑。结合CRISPR-Cas9和类器官可以让研究人员开发更多生理相关的体外人类疾病模型并研究器官发育。
下面,我们描述了一种CRISPR-Cas9基因组编辑人类肠道类器官的方案interticult™类器官生长培养基(人)(目录#06010)使用ArciTect™基于CRISPR-Cas9核糖核蛋白(RNP)的系统和STEMCELL的RNA设计工具.
材料
- architect™Cas9核酸酶* (目录#76002 / 76004)
- ArciTect™sgRNA† (目录# 200 - 0013)
- architect™人类CRISPR优化试剂盒(目录号100-0470,100-0471,100-0472)
- interticult™类器官生长培养基(人)(目录# 06010)
- interticult™OGM Human basic Medium, 50 mL(原interticult™OGM Human Component A)
- 类器官补充剂,50ml(原inteticult™OGM Human Component B)
- DMEM/F-12带15mm HEPES (目录# 36254)
- 25%磷酸缓冲盐水(PBS)牛血清白蛋白(BSA)
- 康宁®Matrigel®基质,生长因子还原(GFR),无酚红(康宁356231)
- D-PBS(不含钙、镁)(目录# 37350)
* architect™Cas9-eGFP核酸酶(目录#76006)也可以使用。所有检测均使用architect™Cas9核酸酶进行。
†本产品仅在澳大利亚、奥地利、比利时、加拿大、中国、丹麦、芬兰、法国、德国、冰岛、爱尔兰、卢森堡、荷兰、新西兰、挪威、波兰、葡萄牙、新加坡、西班牙、瑞典、瑞士、英国和美国有售。
有关使用inteticult™类器官生长培养基(人)培养和传代人类肠道类器官的信息,请参阅产品信息表(文档#DX21423)。
所需材料以每口井为基础进行说明。这些值需要根据实验中井的实际数量进行放大。当靶向一个新基因时,经常测试多个引导RNA (gRNA)靶向序列,因为不同的gRNA可以在靶标上和靶标外位点表现出一系列的靶向/编辑效率。单导RNA (sgRNA)可以使用RNA设计工具从干细胞。该工具使用最佳实践和最新的计算工具来设计人类和小鼠基因组中每个基因的最佳靶向序列。
协议
第一部分:architect™sgRNA工作溶液的制备
- 打开前将小瓶短暂离心。
- 每个小瓶中加入无核酸酶的水,得到终浓度为100μM的单导RNA (single guide RNA, sgRNA),如表1所示。
表1。悬浮体积为100 μM* ArciTectTM sgRNA
architect™sgRNA的数量 无核酸酶水体积(µL) 4 nmol 40 *100µM = 100 pmol/µL
- 彻底混合。如果不立即使用,应在-20°C中保存6个月或在-80°C中保存6个月以上。等分解冻后,立即使用。不要重新冷冻。
第二部分:Compete intestinal™类器官生长培养基(人)和DMEM + 1% BSA的制备
使用无菌技术制备完整的inteticult™类器官生长培养基(人基础培养基+类器官补充)。下面的例子是准备100ml完全培养基。如果准备其他卷,请进行相应调整。
- 解冻人体基础培养基&类器官补充在室温(15 - 25°C)或2 - 8°C过夜。彻底混合。
注意:一旦解冻,立即使用或冷藏,并在-20°C保存长达3个月。解冻后立即使用。不要重新冷冻。 - 向50ml人基础培养基中加入50ml类器官补充品。彻底混合。
注意:如果不立即使用,将完整的培养基在2 - 8°C下保存最多1周。 - 使用前立即添加所需的抗生素(例如50µg/mL庆大霉素或100单位[100µg/mL]青霉素/链霉素)。
采用无菌技术制备DMEM + 1% BSA。下面的例子是制备50ml DMEM + 1% BSA。如果准备其他卷,请进行相应调整。
- 在50ml锥形管中加入2ml 25% BSA至48ml DMEM/F-12, 15mM HEPES(例如目录#38010)。
- 倒转拌匀。放在冰上。
注意:如不立即使用,可在2 - 8°C下保存6个月。
第三部分:肠类器官单细胞电穿孔混悬液的制备
- 在37°C培养箱中加热24孔组织培养板至少2小时,然后镀基质圆顶。
- 将完整的肠道™类器官生长培养基(人)加热至室温。
注意:对于每孔电镀(电穿孔条件),将需要750µL培养基。 - 在冰上解冻Matrigel®。
注意:对于每个要电镀的孔(电穿孔条件),需要25µL的Matrigel®。 - 将DMEM + 1% BSA放在冰上。
- 每孔准备1 mL ACCUTASE™+ 10µM Y-27632待收集。加热至室温。
- 小心地从每个孔中取出并丢弃介质,以收集电穿孔,而不会干扰Matrigel®圆顶。
- 在每口井暴露的圆顶顶部加入500µL accuase™+ 10µM Y-27632。室温孵育1分钟。
- 用DMEM + 1% BSA预湿1ml吸管头;使用这个移液器尖端彻底冲洗和刮去井底的Matrigel®穹顶。用移液管上下移液2 - 3次,使穹顶和类器官破裂。确保所有的Matrigel®片都被冲洗干净。
- 使用相同的移液管尖端,将类器官混合物转移到不含DNase和rnase的微离心管中。
注意:如果从多个孔中收集类器官,将混合物转移到15ml Falcon®管(目录# 38009). - 在同一孔中加入500µL ACCUTASE™+ 10µM Y-27632,并使用预湿移液管尖端释放任何剩余的Matrigel®。将类器官混合物转移到与上述相同的试管中。
- 在37°C水浴或热块中培养类器官混合物20分钟。从孵育中取出,每5分钟上下移液15 - 20次,以分离Matrigel®圆顶并将类器官解离成单细胞悬浮液。
注意:用相差显微镜检查细胞悬液,以确保在20分钟孵育后产生单细胞悬液。 - 300倍离心细胞悬液g5分钟。
- 去除上清,用1ml DMEM + 1% BSA重悬细胞颗粒。通过细胞过滤器运行悬浮液。细胞计数。
- 准备1 x 105细胞每电穿孔反应和离心在300倍g5分钟。
- 立即进行第四部分。
第四部分:用于电穿孔的architect™CRISPR-Cas9 RNP复合物混合物的制备
- 为了制备RNP复合物混合物,将表2 (Neon®Electroporation)或表3 (4d - nucleoector™X Electroporation)中列出的组分按顺序组合在微离心管中。根据需要的转染次数调整组分体积。
表2。利用sgRNA制备用于Neon电穿孔的RNP复合物混合物
组件 霓虹灯®电穿孔
每反应体积(μL)再悬浮缓冲液T 6.00 architect™Cas9核酸酶(4 μg/μL;25μM) * 0.90 100 μM sgRNA 0.60 总计 7.50 注:- 可能需要对不同的单元源进行优化。建议Cas9与引导RNA的摩尔比为1:2(如图所示)至1:8。
- 这些值适用于单个电穿孔反应,包括Neon®电穿孔的移液误差。必要时扩大规模。
表3。4d - nucleoector™X电穿孔用sgRNA制备RNP复合物混合物
组件 4D-Nucleofector™X电穿孔
每反应体积(μL)P3原代细胞核因子™溶液(含补充物1 6.00 architect™Cas9核酸酶(4 μg/μL;25μM) * 0.90 100 μM sgRNA 0.60 总计 7.50 注:- 可能需要对不同的单元源进行优化。建议Cas9与引导RNA的摩尔比为1:2(如图所示)至1:8。
- 这些值适用于单个电穿孔反应,包括4D-Nucleofector™X电穿孔的移液误差。必要时扩大规模。
- 彻底混合。
- RNP复合物在室温(15 - 25°C)下孵育10 - 20分钟。
第五部分:肠道干细胞与RNP复合物的电穿孔
使用Neon®转染系统(a部分)或Lonza®4d - nucleoector™X Unit (b部分)进行电穿孔。
a)电穿孔使用Neon®转染系统
- 从细胞颗粒(在第三部分中制备)中抽吸上清。每个电穿孔条件下,用7.5 μL的重悬液T重悬细胞,上下用力移液混合。
- 将7.5 μL细胞悬浮液移入每7.5 μL RNP Complex Mix(第四部分配制)中,轻轻上下移液混合,尽量不形成气泡。
- 用10 μL Neon®移液头抽取10 μL混合物,检查毛细管是否无气泡,放入含有3ml电解缓冲液E的电孔室。
注意:如果细胞电穿孔时尖端存在气泡,细胞活力和转染效率将显著降低。 - 使用表4中的设置将混合物电穿孔。
注意:请参阅制造商关于电穿孔的说明。电穿孔条件可能需要针对不同的细胞源进行优化。表4。使用Neon®转染系统肠细胞的推荐电穿孔条件
电穿孔参数 电势 1600 V 脉冲宽度 20女士 脉冲数 2
b)使用Lonza®4d - nucleoector™X单元电穿孔
- 从细胞颗粒(在第三部分中制备)中抽吸上清。将细胞重悬于17.5 μL的P3原代细胞核因子™溶液+补充物1中(每个电穿孔条件),上下用力移液混合。
- 将17.5 μL细胞悬浮液移至每个7.5 μL RNP Complex Mix(第四部分配制)中,轻轻上下移液混合,尽量不形成气泡。
注意:当细胞电穿孔时,如果在试管中存在气泡,细胞活力和转染效率将显著降低。 - 将25 μL细胞悬液+ RNP复合物混合液转移到16孔Nucleocuvette™条带的一孔中。轻轻拍打或使用吸管头确保没有气泡存在。
- 将Lonza®4d - nucleoector™X单元设置为程序代码DS-138。
- 将Nucleocuvette™试纸条置于4D-Nucleofector™X Unit的穿梭装置中,选择OK加载试纸条,然后选择Start开始电穿孔。
第六部分:后期编辑文化
- 电穿孔后,立即将细胞转移到无DNase和rnase的微离心管中。300倍离心g5分钟。
- 取上清液,用25 μL冷水DMEM + 1% BSA重悬细胞颗粒。上下用力移液10次,彻底重悬单细胞悬浮液。注意不要产生气泡。把管子放在冰上。
- 在样品管中加入25 μL Matrigel®。上下移液器混合。避免产生气泡。将试管放在冰上,直到准备好装盘。
- 预热24孔组织培养处理板过夜或至少1至2小时。
- 使用预湿的移液管尖端,抽取50 μL的Matrigel®细胞悬液,加入24孔组织培养处理板的1孔中,如下所示:
一个。将移液器垂直置于孔的中心。将移液器的尖端靠近但不要接触到井底。
b。轻轻按压柱塞,直到在移液器的末端可以看到液滴。
c。慢慢降低移液器,直到液滴接触到井底。
d。轻轻分配(仅在移液器上的第一个停止)剩余的体积,同时将移液器从井中抬起。
注意:将Matrigel®细胞悬浮液从冰中取出后,在60秒内迅速将其板载。 - 小心地将平板转移到37°C的培养箱中。孵育10分钟,让穹顶凝固。不要打扰穹顶。
- 在每孔中加入750 μL添加10 μM Y-27632(终浓度)的完整肠子™类器官生长培养基,将培养基沿孔壁缓慢移液。不要直接移液到穹顶上。
- 在未使用的井中加入无菌PBS以保持潮湿的环境。将盖子放在培养板上,在37°C和5% CO下孵育2.
- 每2天,用完整的inteticult™类器官生长培养基进行全培养基更换。
- 培养7 - 10天后收获细胞,评估基因组编辑效率。
数据
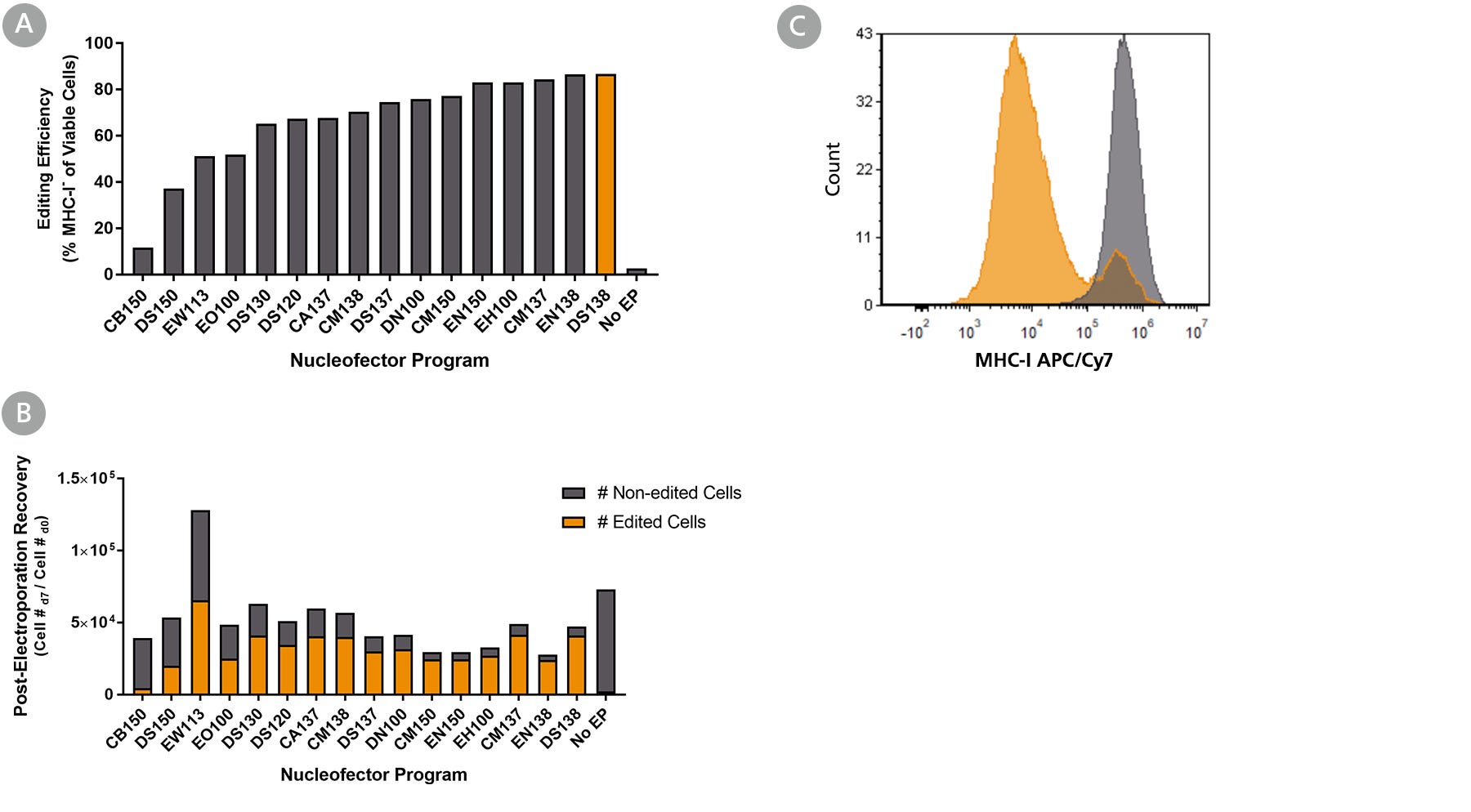
图1所示。利用4d - nucleoector™系统优化肠道类器官细胞RNP递送
肠道类器官来源于健康对照(结肠活检样本,a系),并在inteticult™类器官生长培养基(人)中培养10代。含有ArciTect™Cas9核酸酶和ArciTect™sgRNA的RNP复合物B2M使用指定的4D-Nucleofector™程序传递基因,并通过流式细胞术检测主要组织相容性复合体(MHC) I类分子(MHC-I)的表面表达来监测编辑效率。(一个)电穿孔后7天,使用architect™Human CRISPR Optimization Kit (APC)通过流式细胞术检测编辑效率,检测功能敲除B2M通过检测细胞表面MHC-I表达的缺失。(B)编辑细胞(橙色条)和未编辑的肠道类器官细胞(灰色条)的总数通过编辑效率乘以电穿孔后恢复来计算;这表明哪种电穿孔程序导致最佳的整体编辑效率和细胞回收率。(C) RNP电穿孔MHC-I流式细胞术数据的代表性直方图(RNP,橙色;DS-138)和非电穿孔(无EP;含有sgRNA靶向的CRISPR-Cas9 RNP复合物递送后7天肠类器官细胞B2M.
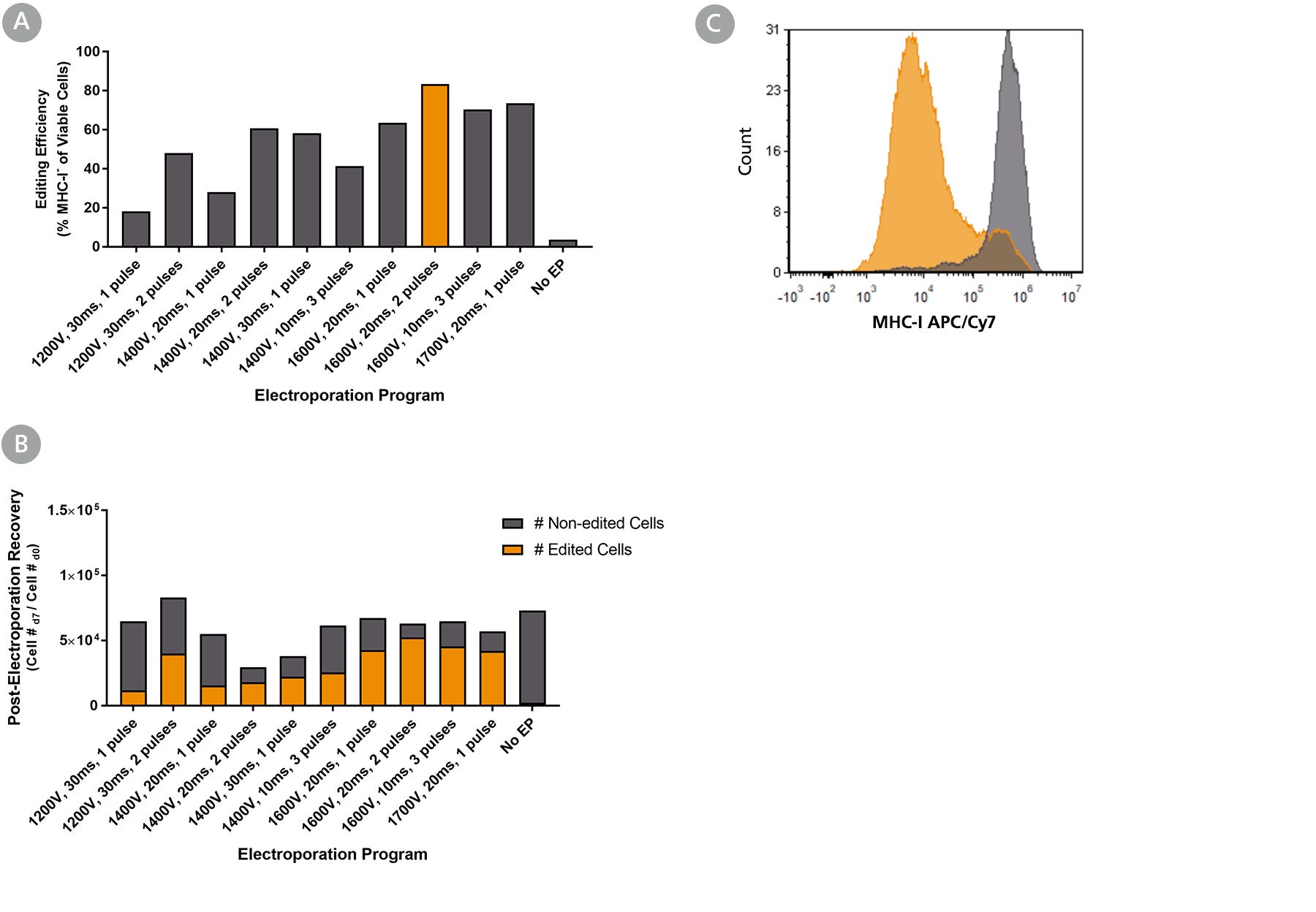
图2。利用Neon®转染系统优化肠道类器官细胞RNP传递
肠道类器官来源于健康对照(结肠活检样本,a系),并在inteticult™类器官生长培养基(人)中培养10代。含有ArciTect™Cas9核酸酶和ArciTect™sgRNA的RNP复合物B2M使用指定的Neon®转染系统设置传递基因,流式细胞术检测编辑效率,检测主要组织相容性复合体(MHC) I类分子(MHC-I)的表面表达。(一个)电穿孔后7天,使用architect™Human CRISPR Optimization Kit (APC)通过流式细胞术检测编辑效率,检测功能敲除B2M通过检测细胞表面MHC-I表达的缺失。(B)编辑细胞(橙色条)和未编辑的肠道类器官细胞(灰色条)的总数通过编辑效率乘以电穿孔后恢复来计算;这表明哪种电穿孔程序导致最佳的整体编辑效率和细胞回收率。(C) RNP电穿孔MHC-I流式细胞术数据的代表性直方图(RNP,橙色;1600v, 20ms, 2个脉冲)和非电穿孔(无EP;含有sgRNA靶向的CRISPR-Cas9 RNP复合物递送后7天肠类器官细胞B2M.
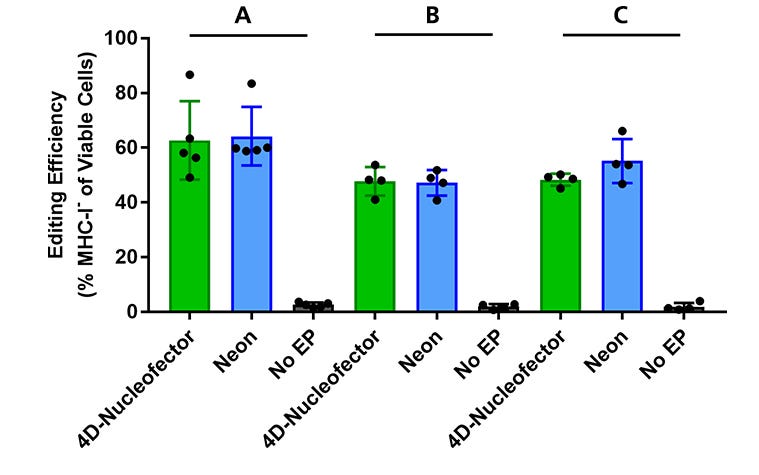
图3。使用4d - nucleoector™或Neon®转染系统验证肠道类器官细胞优化的RNP递送电穿孔程序
肠道类器官来源于健康对照活检样本(结肠样本:A系和B系;小肠样本(品系C),并在intesteticult™类器官生长培养基(人)中培养。含有ArciTect™Cas9核酸酶和ArciTect™sgRNA的RNP复合物B2M使用4d - nucleoector™系统(程序代码:DS-138)或Neon®转染系统(1600 V, 20 ms, 2脉冲)传递基因,并通过流式细胞术检测编辑效率,以检测主要组织相容性复合体(MHC) I类分子(MHC-I)的表面表达。