间充质基质细胞调查结果
群体异质性、血清问题、命名法等
间充质基质细胞(也称为间充质干细胞,MSC)是细胞治疗领域中一个活跃的研究领域。尽管MSC在研究项目和临床试验中得到广泛应用,但该领域的顶尖研究人员认为,这些细胞的特征仍不明确,需要更清晰的命名规范。
2019年,STEMCELL Technologies 牵头开展了一项调查,邀请 MSC 研究人员就该领域的现状发表看法。来自世界各地的 450 名研究人员参与了此次调查,调查结果汇总于 信息图表 中。本文,我们重点介绍了调查结果中的一些有趣发现并进行评论。
当您在 MSC 培养基中使用血清时,您对实验结果/可重复性有多担心?
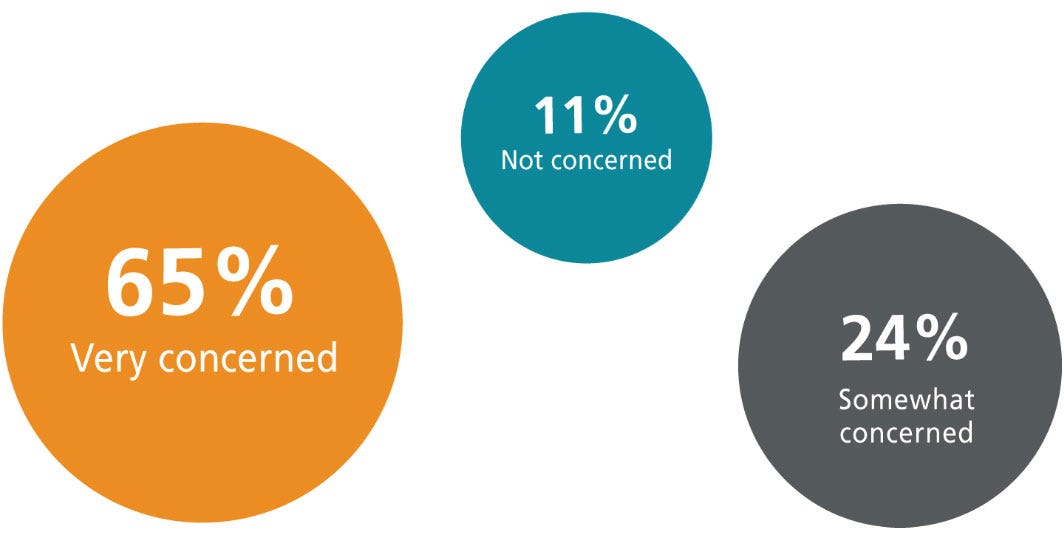
传统上,MSCs 是在含有胎牛血清 (FBS) 的培养基中培养的。然而,使用血清等动物源性成分(尤其是 FBS)的问题日益引起许多科学家的担忧。众所周知,FBS 的批次间差异较大,会影响实验的可重复性。
血清成分会因来源者的年龄、饮食、地理位置、血清采集季节以及其他因素而有所不同。1 研究表明,不同批次血清的含量差异会影响细胞功能及其与药物分子的相互作用。2,3 研究人员可能会尝试通过严格的血清批次筛选来尽量减少差异。然而 , 此类筛选过程可能复杂、昂贵、耗时且主观性较强。因此,建议在整个研究过程中使用同一批血清, 1 因为筛选并不能始终确保不同批次血清之间的等效性,进而影响实验的可重复性。
血清以及其他源自人类和动物的成分含有大量的细胞外囊泡 (EV),包括外泌体。4,5 细胞 培养物中这些 EV 的存在会影响实验结果。例如,研究表明,FBS 衍生的 EV 会促进乳腺癌细胞的生长 6 或污染从细胞培养物中分离的目标 EV 7,8 。使用不含动物成分和 EV 的试剂可以减少 EV 污染造成的实验伪影。
FBS 就像是我们头顶上的一片乌云,不知道什么是真实的,什么不是。
Baker等人,《自然》2016
血清和其他动物源性成分的另一个主要问题是病毒、支原体等污染的风险。最近对来自12家不同制造商的26份牛血清样本进行的同色异谱评估表明,除一份样本外,其余样本均存在病毒污染。9细胞培养基中包含的 其他 人源性或动物源性成分也可能存在类似问题,越来越多的研究人员得出结论,应尽可能优先选择不含动物成分的培养基 。10
MSCs 本质上高度异质性,且对培养条件非常敏感。为了最大限度地减少血清和其他动物源性成分引起的实验差异和人为因素,我们开发了 无血清和无动物源性成分的 MesenCult™ ACF 工作流程 ,可支持您从 MSC 的提取、扩增 到 软骨分化 的整个研究过程。该工作流程还包含 STEMdiff™ 间充质祖细胞试剂盒, 用于从人类多能细胞(即诱导多能干细胞 (iPS) 和胚胎干细胞 (ES))中生成间充质祖细胞 (MPC)。
探索STEMCELL 提供的 其他 不含动物成分的产品。
作为 MSC 研究员,您面临的最大挑战是什么?
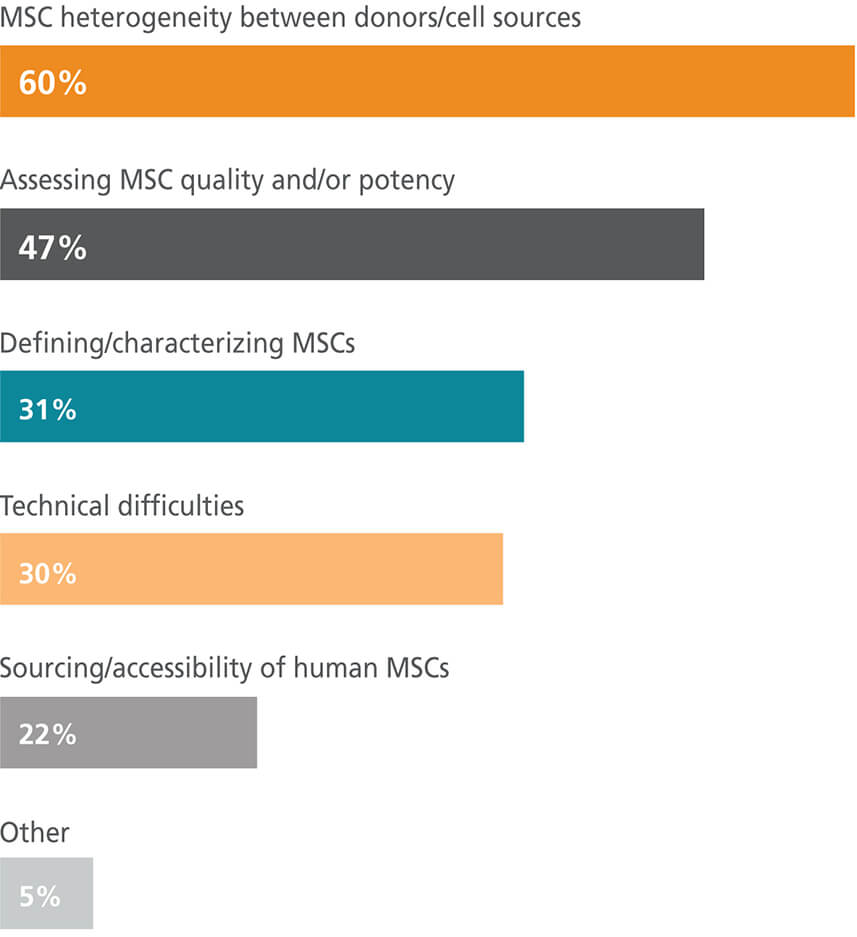
MSC是一个涵盖性术语,用于指代不同组织来源、特性各异的细胞。越来越清晰的是,统称为MSC的细胞从不同组织解离时,其转录组和分化能力也有所不同。11–14 目前 ,该领域的许多领军人物倡导更清晰的命名法,并建议在出版物中明确其来源组织。15–18加剧细胞异质性担忧的是,从不同供体的同一组织,甚至同一供体的同一组织中分离 的 MSC群体的细胞特性可能存在差异 。19,20
研究人员必须保持警惕和创造力,以确保他们使用的细胞在整个研究过程中是一致的。
Baker等人,《自然》2016
最大限度地减少组织/供体差异的一种方法是使用源自人类多能干细胞 (hPSC) 的 MSC,这种细胞来源更加同质,具有无限扩增的潜力。21 研究 表明,源自人类 ES 22 和 iPS 23 细胞的 MSC 具有与源自成体组织的 MSC 相似的体内和体外特性。hPSC 可以为研究和临床目的提供取之不尽、用之不竭的 MSC 生成来源 。24
完全无动物成分的 STEMdiff™ 间充质工作流程 经过优化,适用于从 ES 细胞和 iPS 细胞分化和培养间充质祖细胞 (MPC)。与 MSC 不同,MPC 并非源自组织基质,因此与原代细胞相比,MPC 的异质性更低。
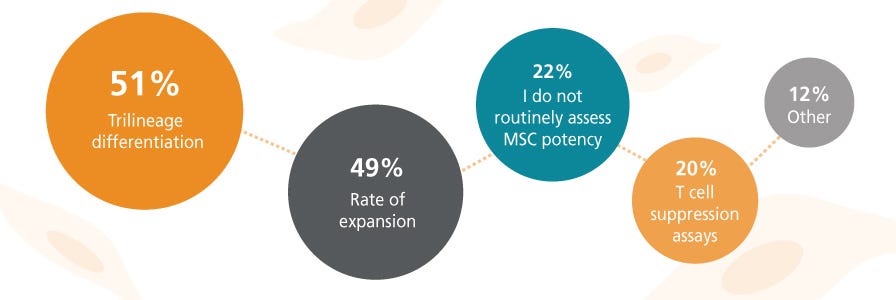
选择 MSC 培养基或试剂时,您最关注的是什么?
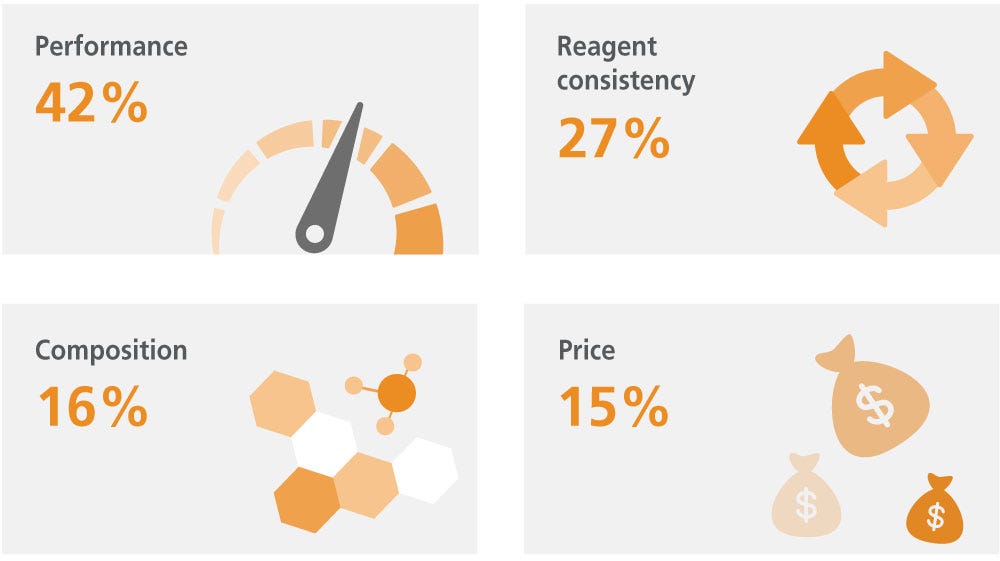
由于MSC固有的异质性及其对培养条件的敏感性,确定标准化的培养体系及其表型一直颇具挑战性。MSC对培养条件的变化非常敏感,以至于在培养板中心生长的细胞可能表现出与周围细胞不同的特性 。25
血清可以说是细胞培养基中最常见的补充剂,也可以说是最不一致的。
Baker等人,《自然》2016
人们倾向于仅根据高性能(高细胞扩增率或分化能力)特性来选择培养系统和/或条件,而忽视了一致性和可重复性的重要性。例如,一些研究人员偏爱能够促进细胞快速生长的培养基/血清批次,却忽略了其对可能随培养条件变化的其他细胞特性的影响。务必牢记,尤其是在处理敏感的异质性细胞(例如MSC)时,尽管培养基性能在培养MSC时至关重要,但培养系统的一致性也不容忽视。如前所述,血清和其他动物成分会显著影响实验的变异性和培养的不一致性。使用不含动物成分的产品可以最大限度地减少可重复性问题,并节省研究人员在血清批次/试剂筛选上的时间和金钱。
MesenCult™-ACF Plus 培养基 可让您在不使用血清或其他动物源性产品的情况下持续提取和扩增 MSC,同时保持其性能。在此培养基中培养的 MSC 可维持体外三系分化,并表达国际细胞治疗学会 (ISCT) 定义的细胞表面标志物。MesenCult™-ACF Plus 不含污染性胞外囊泡 (EVs),是研究和使用 MSC 衍生胞外囊泡的研究人员的理想选择。
探索STEMCELL 提供的 其他 不含动物成分的产品。
您首选的术语是什么来指代 MSCs?

间充质干细胞、间充质基质细胞和药用信号细胞是指代 MSC 的众多术语中的几种。“间充质干细胞”最初由 Arnold Caplan 于 1991 年创造 27 ,至今仍是描述 MSC 的最常用术语。然而,许多人认为使用该术语会造成混淆,并且不能准确反映细胞的来源和特性。该领域的领导者提出了不同的名称来解决这种差异。2017 年,Caplan 根据有关 MSC 分泌组在其治疗效力中的作用的新发现,提出了“药用信号细胞”这一名称 28–29 Caplan 敦促业界停止使用“间充质干细胞”这一术语,以避免暗示 MSC 是干细胞而进一步误导公众。 30 其他研究小组认为——因为已经证明骨髓衍生的 MSCs 中的亚群可以在体内具有多能性,甚至能够建立造血微环境 31 ——“干细胞”一词实际上是指 MSCs 的正确方式。
称它们为 MSCs,但请不要称它们为干细胞。
Caplan,《干细胞转化医学》2017
为了解决关于MSC命名的争议,ISCT MSC委员会最近发布了一篇评论 18 ,建议在大多数情况下使用“间充质基质细胞”。在其2019年的《细胞疗法》评论文章中,ISCT MSC委员会强调需要“更严格的科学审查、讨论和论述”。虽然委员会认为“间充质”一词仍然适用,但建议在报告数据时具体说明来源组织(例如骨髓来源的MSC)。更重要的是,除非体外和体外功能分析都证明其具有干性,否则鼓励研究人员在提及MSC时避免使用“干”一词。使用一系列功能分析 32,33 可以更准确地确定这种异质细胞群的特征,并深入了解其是否具有干性。有关MSC命名法争论的更多信息,请访问 间充质基质细胞争论与更新 。
总而言之,本次调查的结果反映了MSC研究人员面临的一些挑战,并突出了该领域潜在的改进领域。持续的公开讨论至关重要,也值得鼓励,因为这将有助于社区应对这些挑战,并拓展我们对MSC的认知。完整的调查结果可 在此处 查看。
参考
- Baker M. (2016) Nature 537(7620): 433–5.
- Sikora MJ et al. (2016) Endocrinology 157(10): 3760–3766.
- Khodabukus A & Baar K. (2014) J Cell Biochem 115(12): 2198–207.
- Keller S et al. (2011) J Transl Med 9: 86.
- Lässer C et al. (2011) J Transl Med 9: 9.
- Ochieng J et al. (2009) Exp Cell Res 315(11): 1875–88.
- Théry C et al. (1999) J Cell Biol 147(3): 599–610.
- Théry C et al. (2001) J Immunol 166(12): 7309–18.
- Toohey-Kurth K et al. (2017) Biologicals 47: 64–68.
- van der Valk J & Gstraunthaler G. (2017) Altern Lab Anim 45(6): 329–332.
- Sacchetti B et al. (2016) Stem cell reports 6(6): 897–913.
- Sakaguchi Y et al. (2005) Arthritis Rheum 52(8): 2521–9.
- Guillot P V et al. (2008) Differentiation 76(9): 946–57.
- Melief SM et al. (2013) Stem Cells Transl Med 2(6): 455–63.
- Sipp D et al. (2018) Nature 561(7724): 455–457.
- Caplan AI. (2017) Stem Cells Transl Med 6(6): 1445–1451.
- Boregowda S V et al. (2018) Stem Cells 36(1): 7–10.
- Viswanathan S et al. (2019) Cytotherapy 21(10): 1019–1024.
- Phinney DG et al. (1999) J Cell Biochem 72(4): 570–85.
- Phinney DG et al. (1999) J Cell Biochem 75(3): 424–36.
- Wang H et al. (2019) Theranostics 9(6): 1683–1697.
- Gruenloh W et al. (2011) Tissue Eng Part A 17(11–12): 1517–25.
- Hynes K et al. (2013) J Dent Res 92(9): 833–9.
- Sabapathy V & Kumar S. (2016) J Cell Mol Med 20(8): 1571–88.
- Ylöstalo J et al. (2008) Exp Hematol 36(10): 1390–402.
- Caplan AI. (1991) J Orthop Res 9(5): 641–50.
- Meirelles L da S et al. Cytokine Growth Factor Rev 20(5–6): 419–27.
- Caplan AI & Correa D. (2011) Cell Stem Cell 9(1): 11–5.
- Caplan AI & Dennis JE. (2006) J Cell Biochem 98(5): 1076–84.
- Caplan AI. (2017) Stem Cells Transl Med 6(6): 1445–1451.
- Muguruma Y et al. (2006) Blood 107(5): 1878–87.
- Chinnadurai R et al. (2018) Cell Rep 22(9): 2504–2517.
- Galipeau J et al. (2016) Cytotherapy 18(2): 151–9.